약방의 감초, 만병의 근원?
활성산소란 말을 들으면 약방의 감초가 떠오른다. 질병과 관련된 논문이나 연구보고서들을 들으면 어디서나 항상 출석표를 찍는다. 더 나아가 텔로미어(telomere)를 공격하여 노화 촉진에도 관여한다고 한다. 왜 그럴까. 그리고 궁금하다. 활성산소가 대체 무엇인가. 두리뭉실하게 빌런인 건 알겠는데 어떻게 나쁜 건지, 그리고 정말 해롭기만 한 것인지 좀 제대로 세밀하게 알아보고 싶어 작정했다. 활성 산소. 활성된 산소라는 뜻이리라. 그렇다면 활성이 무엇인지부터 시작해 보자.
활성이란?
안정되지 못하고 다른 물질과 쉽게 반응할 수 있는 상태를 활성상태라고 한다. 영어로 Reactive이고 라디칼(radical)이라고도 한다. 안정된 상태의 원자들은 에너지 레벨이 낮고 활성이 적다. 그렇다면 왜 활성을 갖게 되었을까. 앞 글들에서 원자들이 가지고 있는 전자들을 궤도(오비탈)에 차곡차곡 위치시키는 규칙들을 살펴보았다. 그리고 우리는 각 오비탈이 최대 2개씩의 전자를 가질 수 있다는 것도 살펴보았다. 사실 전자들은 이렇게 2개씩 쌍으로 움직이는 것을 좋아한다. 그런데 만일 어떤 이유로 전자 하나를 잃거나 빼앗겨 버린다면, 짝을 잃고 무척 불안정해진다. 더 이상의 안정과 평온이 깨어지고 잃어버린 전자 하나를 어디선가 다시 채우기 위해 여기저기 기웃거리면서 거칠어질 것이다. 라디칼이라는 말은 "난폭하다. 날뛴다"라는 이미지를 연상시킨다. 활성산소가 전자를 잃어버린 것과 관련이 있음을 눈치챌 수 있다.
라디칼(Radical)의 정의
이렇게 쌍으로 존재하지 않는 전자가 하나 이상 포함된 분자를 라디칼이라고 한다.[1] 사실 전자는 일반적으로 쌍으로 존재한다. 물질을 이루기 위해 원소들은 다양한 화학결합 방식을 통해 분자를 이룬다. 서로 하나씩의 전자를 내놓아 쌍을 이루며 결합하는 공유결합의 방식을 보면 홀수의 원자번호를 가지는 원소 역시 라디칼이 되지 않는 이유를 알 수 있다. 사실 분자가 나뉘어질때도 전자가 쌍을 이룬 상태를 유지하며 분해된다. 하지만 비정상적으로 분자가 쪼개질 때, 안정적인 공유결합 상태를 절단시키는 상태에서 반으로 쪼개지면 각각 쌍을 이루지 못하는 두 개의 홀수 전자가 생겨나는 것이다. 이것이 라디칼이다.
라디칼의 무서운 특성: 연쇄성
라디칼은 짝을 잃어 불안정해진 자신의 상태를 회복하기 위하여 새로운 짝을 구해야 하고, 그 방법으로 주변의 다른 분자를 공격하여 전자를 뺏어온다. 그래서 안정을 찾아 자신은 만족스러운 상태가 된다. 하지만 문제는 이렇게 갑자기 자신의 파트너를 빼앗겨 버린 그 피해자 분자가 또다시 라디칼이 되어 버렸다는 것이다. 라디칼이 라디칼을 낳은 것이다. 그러면 이 라디칼 역시 자기의 짝을 채우기 위해 즉시 주변에서 누군가를 공격해 전자를 빼앗아 올 것이다. 아주 짧은 시간에 이러한 연쇄 반응이 일어난다. 처음 발생한 라디칼이 '개시'가 되어 연쇄적으로 발생하는 라디칼들의 전자 뺏기로 수많은 라디칼 반응이 일어나는 것을 '전파'라고 한다. 수없이 연쇄적으로 반복되는 라디칼의 비라디컬을 향한 공격, 그리고 결국은 높아진 라디칼의 농도 속에서 마침내 라디칼끼리 서로 반응하여 안정된 비라디칼 화합물을 생성해 내면 결국 연쇄반응이 끝나고 이것을 '종결'되었다고 한다. 아마도 이 연쇄성이 라디칼의 가장 무시무시한 특성이 아닌가 한다. 실제로 이런 끔찍한 연쇄반응이 우리 몸에서 일어난다. 그 한예가 앞 글에서 언급한 바 있는 세포막에서 일어나는 지질의 산화이다. 아주 오랫시간동안 한 곳에서 지속적으로 라디칼 연쇄반응이 생겨난다면 필시 치명적인 결과를 초래할 것이다.
산화와 환원(Redox)
짝을 이루던 전자쌍이 전자를 잃고 더이상 쌍을 이루지 못한다는 상황에서, 필연적으로 우리는 산화와 환원이라는 개념을 만나게 된다. 화학적 반응에서 어떤 원자나 분자가 전자를 잃거나, 산소와 결합하거나, 또는 수소를 잃는 경우를 산화(oxidation)라고 한다. 이름에서 알 수 있듯이 처음에는 산소와 결합하는 경우를 의미했지만 이후 산소가 없어도 산화가 일어남이 밝혀졌다. "전자를 잃는다"가 더 일반적인 정의가 아닌가 한다. 환원은 그 정반대이다. 즉, 전자를 획득하거나, 산소와 분리되거나, 혹은 수소와 결합하는 경우이다. 흔히 산화와 환원은 세트로 동시에 일어난다. 전자를 잃는 자가 있으면 얻는 자가 있는 것이 순리가 아니겠는가. 따라서 활성산소는 전자를 잃고 획득하는 산화와 환원반응(Redox: reduction and oxidation)의 과정에서 발생함을 알 수 있다.
"전자를 잃다" - 에너지 생산을 위한 필수조건
이 간단한 현상이 얼마나 중요한 의미를 갖는지 알고 보면 참으로 경이롭다. 전자를 잃는 사소한(?) 과정을 통해 우리는 생명을 유지한다. 한 가지 아주 대표적인 예를 아주 간단히 들여다보자. 음식을 통해 영양분을 섭취한 후, 이들을 피르부산이라는 형태가 될 때까지 여러 과정을 거치면서 정성스럽게 쪼개고 쪼개 반을 만든 후, 이를 세포질에서 미토콘드리아 속으로 쓱 들여보내면, TCA 회로라는 반복 사이클이 촉발된다. NADH와 FADH2로 만들어진 에너지형태를 인체가 사용할 수 있도록 ATP로 바꾸는 공정이 바로 세포 내 미토콘드리아 기질의 내막에 존재하는 전자 전달계이다. 이 과정에서 NADH와 FADH2 가 품고 있던 전자들은 수많은 소단위 단백질들과 세부 과정들이 즐비하게 늘어선 단백질 복합체들을 차례대로 거치면서 계속 전달된다. 그리고 마침내 최종적으로 산소분자에게 전달되면 산소는 이를 받아 주변의 수소와 결합하여 함께 물을 만든다. 산소한테 줄 거면 그냥 바로 줄 것이지 왜 이렇게 복잡한 단계를 거쳐 전자를 옮기는지 의아해진다. 이유가 있다. 전자를 잃을 때에는 에너지가 발생한다. 즉 에너지가 방출된다. 상당한 양이 방출된다. 만일 그 양이 우리 인체가 감당할 수 없을 만큼의 규모라면 어떻게 되겠는가. 무시무시하다. 그래서 그 에너지 방출을 조금씩 조금씩, 감당할 수 있을 만큼 조금씩 방출하게 하기 위해, 직행하지 않고 빙빙 돌아 우회하면서 전달한 것이다.
그렇다면 전자를 옮기면서 만든 에너지를 우리 인체가 바로 취해서 사용하는가? 그렇지 않다. 전자를 옮기면서 발생된 에너지는 사실 미토콘드리아 내막 안에 있는 수소를 미토콘드리아 내막밖으로 밀어내는 데 쓴다. 이렇게 밀어내진 수소가 외막과 내막 사이의 막공간에 잔뜩 모여 내막의 안쪽 즉, 미토콘드리아 기질내막 보다 농도가 훨씬 높아지면 이 두 곳간의 현저한 농도차를 이용해 내막의 수소양성자들이 다시 미토콘드리아 안으로 확 밀고 들어오게 되는데 이때 발생하는 에너지로 ATP, 즉 인체가 사용하는 에너지를 생산한다. 물이 쏟아져 내려오면서 물레방아를 회전시키는 힘 또는 댐에서 높은 곳에서 떨어지는 물의 위치에너지로 터빈을 돌리는 것과 비슷한 원리로 ATP를 생성해 내는 것이다. 2개의 인산기를 가진 ADP가 ATP가 되려면 무기 인산을 하나 더 결합해야 하는 데 이 결합에 필요한 에너지를 수소양성자의 농도차를 이용해 얻어 내는 것이다. 인체가 사용할 에너지 생성 과정, 즉 '세포호흡'은 따로 자세히 포스팅할 생각이다. 장황하게 이 과정들을 거론하는 이유는 바로 이 생명 현상에서 활성산소가 많이 만들어지기 때문이다. 즉, 어쩔 수 없이 필연적으로 일어나는 과정이라는 뜻이다. 전자를 열심히 산소한테까지 소중하게 품어 전달하지만, 중간에 이탈되거나 누락되거나 또는 딴 데로 새어나가는 전자들이 있기 마련이다. 도착지에서 기다리는 산소에게 주지 않고 중도에 엉뚱한 곳으로 새나가는 일종의 배달사고가 빈번히 발생한다. 이렇게 흘러나온 전자가 산화를 일으키는 주인공이 되는 것이다.
산소가 활성산소가 되기까지.
라디칼이 무엇인지, 왜 활성이 일어나는지를 살펴보았으니 이제 산소를 살펴보자. 우선 안정적인 산소가 활성산소로 변해가는 과정들을 보자. 활성산소는 종류가 다양하여 이들을 하나로 묶어 활성산소종(Reactive Oxygen Species)이라고 칭한다. 이 들간에도 상관관계가 있음을 보게 될 것이다.
산소원자
산소원자는 원자번호 8번으로 전자를 8개 가진다. 앞선 글들에서 살펴본 껍질(주양자)과 오비탈에 기반한 전자 배치 규칙을 적용해 보면 산소는 아래 그림과 같은 구조를 가진다. 원자핵에서 가장 가까운 첫 번째 껍질(K껍질)에 있는 s오비탈에 전자 2개, 그리고 두 번째 껍질(L껍질) 안에서 다시 s오비탈에 전자 2개, 그리고 p 오비탈의 3가지 방향별 궤도에 차례대로 하나씩 순서대로 넣으면 px에 2개, py와 pz에 각각 1개씩 하여 총 8개의 전자 배치를 알 수 있다. 두 오비탈에는 전자가 짝을 이루지 못하고 혼자 존재한다.

전자는 원래 쌍으로 존재해야 안정된 상태이다. 하지만 산소의 경우 가장 바깥의 두 오비탈 py와 pz에 각각 하나씩의 전자를 가진다. 여기서 우리는 최외각 전자가 8개가 되어 가장 안정적인 형태를 이루고자 한다는 옥텟규칙을 잠깐 상기해 보면산소가 옥탯규칙을 만족하려면 전자가 2개 더 필요하다.
삼중항산소(triplet oxygen)
위와 같은 전자 배치구조를 가지는 산소원자 2개가 공유결합하여 O2, 즉 우리가 숨 쉬는 삼중항 산소를 만든다.

가장 바깥쪽 궤도의 전자를 서로 공유하면서 그 궤도를 전자쌍으로 채웠다. 하지만 아직도 궤도 하나는 전자가 하나여서 쌍을 이루지 못한 상태이다. 옥텟규칙 관점에서도 아직 1개의 전자가 부족하다. 그리고 쌍을 이루지 못하고 혼자 있는 전자로 인해 불안정한 모습일 것으로 예상된다. 하지만 예외적으로 산소는 이 상태 이대로, 비록 전자가 모두 쌍을 이루고 있지 않음에도 아주 안정적이라고 한다. 우리가 숨 쉬고 살아갈 수 있을 만큼. 그러나 이 안정적인 삼중항 산소가 주변에서 전자 하나를 획득(환원)하게 되면 어떻게 될까?
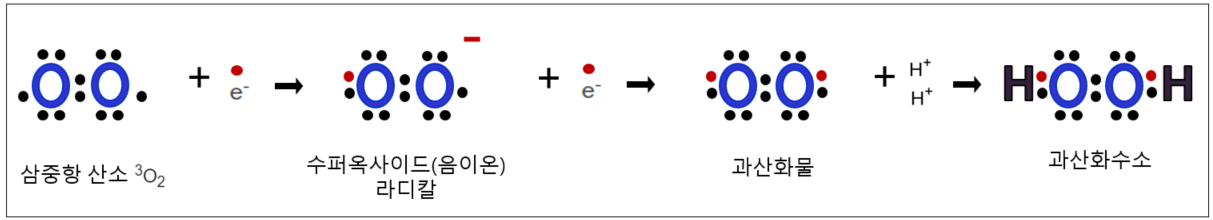
슈퍼옥사이드 음이온 라디칼(초산화 음이온, superoxide anion radical)

L껍질을 묶어서 그림으로 단순화시켜 표현해 보면 위와 같이 된다. 양쪽 산소 원자에서 하나씩 부족했지만 전자 하나를 획득(환원)하여 원자하나는 8개 전자가 되어 옥텟규칙을 만족했지만 한쪽 원자는 아직도 쌍을 이루지 못한 궤도가 하나 남았다. 이런 의문이 든다. 왜 2개의 전자를 한꺼번에 획득하지 않을까. 산소분자는 전자를 한 번에 하나씩의 전자만을 획득할 수 있는 삼중항종이기 때문이다. 위에서 정의했던 쌍을 이루지 못하는 전자가 있는 분자, 즉 라디칼이 형성되었다. 그 이름에서도 폴폴 불안정함이 풍긴다. 쌍을 이루지 못한 저 나머지 전자는 어떡해서든 짝을 찾아 이루고자 애쓰게 됨으로 높은 활성을 가지게 된다. 이름에서 '음이온'은 (-)의 전하를 가지는 전자를 획득하였으므로 전체적으로 (-)의 전하를 가진다는 의미다. 사실 화학공부를 하다 보면 상당히 친숙하지 않은 복잡하고 불친절하고 기다란 화학명을 자주 마주쳐 부담스럽기 그지없는데, 그 명명법을 좀 알고 나면 한결 부담도 줄고 그 속성을 더 잘 이해하게 된다. 이 부분도 더 자세히 공부하여 정리 및 글로 남길 수 있기를 바라본다. 참고로 라디칼 분자는 그 화학식에 점을 찍어 표시한다.
산소원자에서 출발하여 첫 라디칼을 만났다. 우리말로 초산화 음이온이라고 부르는 이 슈퍼옥사이드 라디칼은 라디칼이 모두 그러하듯 다양한 화합물과 반응하여 다양한 화합물을 생성할 수 있는데, 문제는 이들이 주로 그 이름도 유명한 활성산소종(ROS) 생성에 관여한다는 것이다. ROS는 활성이 높은 산소를 포함한 화합물이다. 슈퍼옥사이드는 본인도 라디칼이지만, 여기에서 출발하여 전자를 하나 더 획득하고 수소양성자와 결합으로써 과산화수소를 만들어내게 된다는 점을 기억해야 한다. 또한 과산화수소는 가장 강력하고 해로운 수산화라디칼을 생성해 내는 전단계라는 점에서 슈퍼옥사이드는 중요한다..
과산화수소의 생성
1. 과산화물 (peroxide) 형성
슈퍼옥사이드 라디칼이 주변으로부터 하나의 전자를 다시 획득하여 모든 오비탈에 있는 전자들이 쌍을 이루게 되었다. 과산화물이 형성되었다. 두 개의 산소원자에 유기물이 합성되는 즉, R−O−O−R 구조를 갖는 화합물그룹이다.

2. 과산화수소(Hydrogen Peroxide)
이때 주변에서 전자가 없는 두 개의 수소 양이온(전자가 없는 수소이온이므로 다른 말로 수소양성자라고도 부른다)이 와서 양쪽에 붙는다. 유기물 R에 해당한다. 과산화수소는 아래 그림에서 알 수있는이 모든 전자쌍이 짝을 이루었기 때문에 정의상으로는 라디칼이 아니다. 하지만 앞으로 살펴보겠지만 그 나름대로 큰 해악을 끼치므로 라디칼을 다룸에 있어 눈여겨봐야 한다. 과산화수소는 다른 방법으로도 생성이 가능하지만 일단, 우리는 슈퍼옥사이드로부터 과산화수소가 형성되었음을 꼭 기억하자.

이들의 생성과정을 루이스 점자식으로 표현하면 아래 그림과 같을 것이다.
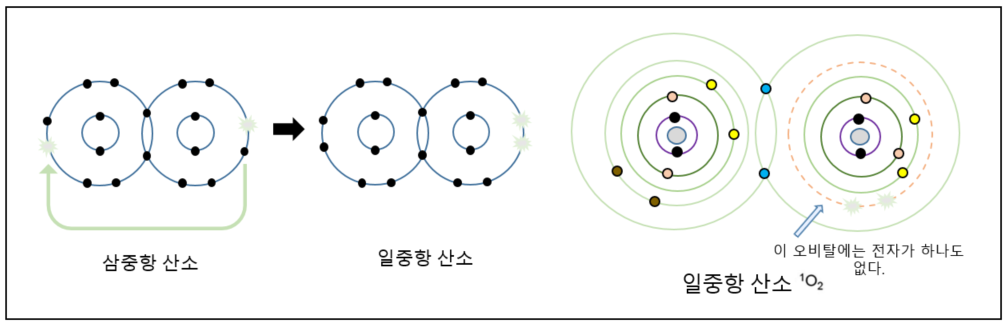
일중항산소(singlet oxygen)
우리가 들이쉬는 가장 일반적인 형태의 산소인 삼중항산소가 다시 하나의 전자를 획득하면 슈퍼옥사이드 음이온 라디칼이 되고 아직도 한쪽 산소원자의 궤도는 짝을 이루지 못함을 보았다. 그런데 각각 하나씩의 오비탈에 짝을 이루지 못하는 전자를 갖고 있는 구조의 삼중항산소에서 어떤 외부적 힘으로 인해, 한쪽 산소 원자의 홀로 있는 전자가 나머지 산소원자의 전자 오비탈로 건너가 그곳에서 쌍을 이루고, 원래 자신이 있던 궤도를 완전히 비워버린다면, 이것을 일중항산소라고 한다. 가장 쉽게 떠올릴 수 있는 특정한 이유로 UV가 있을 수 있겠다.
글 앞부분에서, 인체의 에너지 생성과정인 세포호흡에서 전자를 전달할 때마다 발생하는 에너지를 미토콘드리아기질내부로터 외막으로 수소양성자를 밀어내는 데 사용한다고 하였다. 하나씩 획득할 수 있는 전자, 다량의 H양성자, 그리고 산소가 존재하기 때문에 슈퍼옥사이드는 물론 과산화수소까지 쉽게 생성할 수 있는 환경이 바로 미토콘드리아 내막이다. 우리 인체는 평균적으로 약 30조 개의 세포를 가지고 있다고 추정한다[2]. 그리고 하나의 세포 안에는 신체부위에 따라 차이가 있겠으나 미토콘드리아가 대략 1000 ~ 2500개가 존재한다 [3] . 세포호흡을 통한 ATP 생산이 전체 ATP의 90%를 차지하며 ATP는 일단 만들어지고 나면 저장할 방법이 없기 때문에 끊임없이 생산되야 하는 특징을 가진다. 그렇다면 과연 하루에 얼마만큼의 ATP가 미토콘드리아 내부에서 만들어지는가. 세포하나가 하루에 평균적으로 100억 ATP를 사용하므로 이를 성인 한 명의 필요량으로 계산하면 3.0 × 10 25 ATP 라고한다. 건강한 성인이 하루에 만들어 내는 ATP의 에너지를 환산하면 1200와트라고 한다. 실로 어마어마한 활동이라 하지 않을 수 없다. 우리 몸이 곧 하나의 우주란 생각을 또 하게 된다. 중요한 것은 이 수치들을 통해 이러한 방대하고 어마어마한 규모의 ATP 생성과정에서 필연적으로 수반되는 전자의 이탈과 누락의 스케일을 가늠해 볼 수 있다는 점이다.
지금까지 산소와 관련된 라디칼들을 살펴보았다. 이제 좀 더 구체적으로 과산화수소가 어떻게 가장 악명 높은 수산화라디칼을 탄생시키는지 다음글에서 알아본다.
[참고 자료]
[1] 라디칼의 정의
https://www.britannica.com/science/radical-chemistry
[2] Sender R, Fuchs S, Milo R. Revised Estimates for the Number of Human and Bacteria Cells in the Body.
https://www.ncbi.nlm.nih.gov/pmc/articles/PMC4991899/
[3] Pizzorno J. Mitochondria-Fundamental to Life and Health.
https://www.ncbi.nlm.nih.gov/pmc/articles/PMC4684129/
Mechanism of Superoxide and Hydrogen Peroxide Formation by Fumarate Reductase, Succinate Dehydrogenase, and Aspartate Oxidase
https://www.sciencedirect.com/science/article/pii/S0021925819718407#bib14
'활성산소(ROS)관련' 카테고리의 다른 글
| ROS: 자유라디칼은 필요악(necessary evil)인가. (0) | 2024.03.10 |
|---|---|
| ROS: 신호전달물질로서의 ROS (1) | 2024.03.10 |
| ROS: 활성산소 생산이 목적인 호흡폭발(Respiratory burst) (0) | 2024.03.10 |
| ROS: 활성산소는 어디서 만들어지는가 (0) | 2024.03.10 |
| ROS: 가장 강력한 라디칼: 수산화라디칼(ft 지질과산화) (2) | 2024.03.10 |