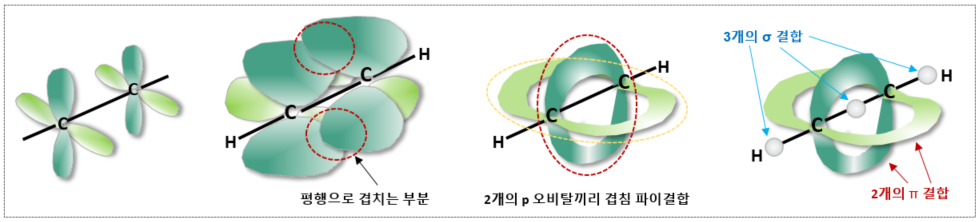
앞 글에서 탄소의 3가지 주요 혼성화 유형의 혼성화 단계를 자세히 살펴보았다. 이 글에서는 혼성화 유형에 따라 어떤 공유 결합형태를 갖게 되는지 알아보고자 한다. 단일, 이중, 삼중 결합은 논리적으로 혼성화의 유형과 밀접한 관련이 있기 때문이다. 탄소는 공유 결합을 이루려 할 때, 몇 개의 결합 파트너와 결합할 것인가에 따라 자신의 2번째 껍질에 있는 s오비탈과 p 오비탈을 혼합하여 혼성 오비탈을 생성할 준비를 한다. 두 오비탈의 에너지 레벨을 동등하게 만든 후, 4개의 원자와 결합하려면 ‘sp3 혼성화’라는 과정으로 4개의 sp3 오비탈을 만들고, 3개의 원자와 결합할 때는 ‘sp2 혼성화’를 통해 3개의 sp2 오비탈을, 그리고 2개의 원자와 결합할 시에는 ‘sp 혼성화’ 방법으로 2개의 sp 혼성 ..