끊임없는 전자의 이동: 산화환원과정은 생명의 과정이다
세포 내 분자 간의 전자 이동을 나타내는 산화와 환원(Redox) 과정은 생명활동 시스템의 근간을 이룬다. 우리의 생명도 결국 원자차원까지 세밀하게 들여다보면 결국은 전자의 이동을 통해 이루어지는 과정들의 연속이라 할 수 있을 것이다. 인체는 이를 통해 에너지를 생산하고, 세포가 기능하고, 신호를 전달할 수 있기 때문이다. 그래서 헝가리 노벨수상자 Albert Szent‐Györgyi가 "인생은 쉴 곳을 찾아다니는 하나의 전자에 지나지 않는다(Life is nothing but an electron looking for a place to rest)."라고 한 말에 한없이 공감하게 된다.
"인생은 쉴 곳을 찾아다니는 하나의 전자에 지나지 않는다."
하지만 이 과정들의 부산물로 산화물질(ROS, reactive oxygen species)의 발생은 피할 수 없다. 세포 내에서 다양한 이유로 과도한 ROS가 축적되면 산화 스트레스가 유발되어 생분자에 손상을 초래할 수 있지만, 세포는 이러한 ROS 농도 변화를 감지하고 대응하는 장치를 다행히 갖추고 있다. 이러한 장치들에게 신호를 보내어 이에 대처하고 적응할 수 있도록 유전자들을 발 빠르게 전사하고 발현시켜 적절한 대응을 하는 것이다. 즉, 우리 인체는 산화와 항산화간의 적절한 균형을 도모하여 항상성을 유지할 수 있는 자체 시스템을 갖추고 있는 것이다.
세포의 항상성(homeostasis) 유지
오랫동안 ROS는 산화환원 반응의 독성 부산물로 간주되어 거대 생분자(DNA, RNA, 단백질 및 지질)를 손상시키고 세포를 사멸시키거나 악성 변화를 유발한다고 알려져 왔다. 또한 조직 손상에서 시작된 각종 질병과 노화의 원인으로 지목되어 경계의 대상이 되어왔다. 그러나 광범위한 연구가 깊이 진행되면서, ROS가 단지 인체에 손상만을 야기하는 악성물질이 아님이 대두되고 있다. ROS가 그 농도를 기반으로 생리학적 신호전달 경로를 규제하는 것이 밝혀지고 있는데 대표적 ROS인 과산화수소(H2O2)의 경우, 세포의 생리학적 신호전달 및 항산화 시스템의 엄격한 통제를 통해 세포 내부에서 생리학적으로 적정한 수준과 범위 내로 유지되어 세포의 증식, 분화 및 사멸을 조절할 수 있게 되어있다. 하지만 만일 H2O2가 이 적정농도범위를 초과할 경우, 세포의 운명을 조절하는 생물 대분자를 파괴하게 된다. 이러한 적정 범위를 넘어서게 되면, 여러 항산화시스템이 작동하여 항산화 반응과 해독작용을 시도하게 된다. 이때 ROS가 필수 적인 생리적 신호전달 물질로 작용하게 된다. 면역체계의 일부인 염증반응에서도 ROS가 염증 신호 전달에 관여함이 잘 알려져 있다.
산화유트레스(Oxidative eustress)
사실, 세포는 대표적인 ROS라 할 수 있는 H2O2의 생성 및 그 생성위치를 세포 내의 특정한 구역이나 영역으로 제한하고 조절할 수 있는 메커니즘을 갖고 있다. 즉, 세포 내에서 특정 기능을 위해 필요한 곳에서만 H2O2의 효과가 나타나도록 보장하면서 세포 내 다른 영역으로 퍼져 전체 세포에 자유롭게 퍼져나가는 것을 방지할 수 있다. 이렇게 세포 내 H2O2를 특정 구역으로 제한하는 것은 해당 영역에서 특정한 신호 전달 경로를 선택적으로 활성화하거나 억제할수 있게 함으로써 다양한 생물학적 과정에 영향을 미칠 수 있다. 다양한 구획이 산화 스트레스에 민감한 특정 단백질이나 효소들과 고유하게 반응하기 때문에 특정 대상을 목표로 하는 산화환원 신호 전달을 가능하게 한다. 이러한 지역적인 H2O2의 생성과 작용은 신호 전달 경로에서 특이성을 유지하면서 과도한 ROS 축적으로 인한 잠재적인 손상을 최소화하는데 기여한다. 세포는 Catalase 등의 각종 산화 제거 효소와 항산화 방어 체계 등을 통해 산화와 항산화 간의 균형을 유지하여 세포 내 항상성을 도모한다. 적정한 양으로 조절되는 H2O2 는 세포 내 원활한 생리활동을 도와주는 점을 부각해 긍정적인 의미를 담은 산화유트레스(oxidative eustress)라는 개념도 있다. 이는 과다한 산화로 발생하는 바람직하지 못한 상태를 의미하는 산화스트레스(oxidative distress)라는 개념과 상반되는 개념이다.
세포가 산화 스트레스를 겪게 되는 상황이 일어났을 때, 산화와 항산화 간의 균형을 유지하고 세포 손상을 피하기 위하여 과산화수소와 같은 ROS가 어떻게 신호전달물질로 역할하는지 살펴보자.
항산화 시스템을 위한 4가지 전사인자와 과산화수소
1. Keap1‐Nrf2 활성 경로
Keap1과 Nrf2(Nuclear factor erythroid 2-related factor2) 간의 상호작용은 다양한 산화 스트레스에 반응하는 티올(Thiols)기반의 산화환원 스위치로서 산화환원의 항상성을 유지하는데 매우 중요한 역할을 한다. Keap1은 세포 내 산화환원 상태를 항상 모니터 하는 센서단백질라 할 수 있다.
Nrf2는 항산화 방어 메커니즘과 관련된 유전자들의 발현을 조절하는 중요한 역할을 한다. 일반적인 상태 즉, 과산화수소와 같은 산화물이 적정한 수위로 존재하는 상태에서는 Keap1 이 'Nrf2 억제 단백질'이라는 그 별명에서 충실하게 Nrf2를 프레테아좀(proteasom)에서 분해되도록 유도하여 Nrf2의 낮은 활성상태를 유지시켜 그 활동을 엄격히 조절함으로써 Nrf2 매개 신호 전달 경로의 과도한 활성을 방지한다. 하지만 과산화수소의 생리학적 농도가 올라가 산화스트레스상태로 돌입하게 될 경우, Keap1 단백질의 구성요소인 시스테인 잔기의 황(Sulfur)들이 산화되어 이황화결합(Disulfide bonding, 아래 참조)을 이루게 된다. 이 결합으로 Keap1의 단백질구조가 변형되면서 결합하고 있던 Nrf2를 놓아주게 된다. 이렇게 풀려난 Nrf2는 세포질을 떠나 세포핵 안으로 들어가고 여기서 항산화 방어 기전에 관여하는 대상 유전자의 프로모터 영역에 존재하는 항산화 반응 요소(ARE: antioxidant response elements)와 결합하여 500개 이상의 항산화 관련 유전자를 발현시키는 마스터가 된다. 이 대상 유전자에는 활성산소 제거 삼총사라고 할 수 있는 Superoxide dismutase(SOD), Catalase, Glutathione peroxidase (GPx)와 같은 다양한 효소들이 포함된다. H2O2 농도를 근거로 Nrf2가 세포 내 산화환원의 항상성을 회복시키고 세포를 산화적 손상으로부터 방어하는데 도움을 주게 된 것이다.
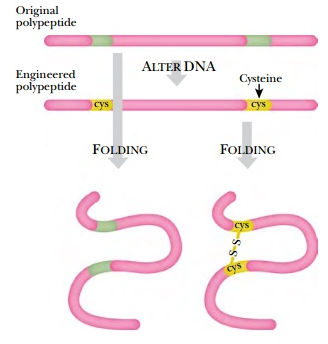
☞ 이황화결합(Disulfide bonding) : 이황화결합이란 산화과정을 거쳐 수소를 잃은 인접하는 두 개의 황(S)이 공유결합을 이루어 1차원적인 단백질 펩티드를 3차 또는 4차 구조와 같이 더 복잡하고 입체적인 구조와 기능을 갖도록 폴딩시켜주는 것을 말한다. 이화황화결합은 단백질 구조 측면에서 상당히 중요하다. 20개 아미노산 중에서 황(S)을 가진 것은 메티오닌(Methionine)과 시스테인(Cysteine) 둘 뿐인데 메티오닌은 황이 끝이 아니라 중간쯤에 위치하고 있어 인접한 다른 황과 결합할수 없는 관계로 이황화결합은 SH기를 가진 시스테인에서만 일어난다. 즉, S(황)과 H(수소)로 이루어진 티올작용기(-SH)를 시스테인 둘 사이에서, 모두 수소를 잃고(산화화여) R−S−S−R′ 형태의 튼튼한 공유결합을 하는 것이다. 이는 동일한 펩타이드 사슬 내에서 서로 다른 펩타이드 사슬 또는 서로 다른 시스테인 잔기를 연결하는 화학 결합으로, 이황화다리(disulfide bridge) 또는 SS결합(SS-bond)이라고도 불리며, 접힘을 통해 단백질 분자 내 펩타이드 사슬의 공간 구조를 안정화시키는 역할을 하는 비교적 안정적인 공유 결합으로 이황화결합의 수가 많을수록 외부 영향에 대한 단백질 분자의 안정성이 커진다. 산화가 잘되는 특성에서 알 수 있듯이, 산화 스트레스조건에서 항산화 방어 경로에 참여하는 단백질 분자 간, 또는 분자 내에서 형성되어 신호전달 경로 조절에 기여한다.

다음은 1차적인 폴리펩타이드 구조가 산화를 통해 시스테인(Cys)간의 이황화결합을 형성시켜 그 부분이 접히게 만듦으로써 3차원적인 구조를 만드는 과정을 보여준다. 효소와 호르몬을 비롯한 수많은 생체 단백질 형성에 이황화결합은 매우 중요한 역할을 한다. 시스테인은 척추동물 단백질의 아미노산 중 약 2%만을 구성하지만, 단백질의 90% 이상이 적어도 하나의 시스테인을 가지고 있다는 것을 고려하면 시스테인이 우리 인체에서 차지하는 중요성을 짐작할 수 있다.
2. FOXO(forkhead box class O) 전사인자
FOXO단백질도 비 산화 조건하에서는 세포질에 존재하며 AKT 신호전달체계에 의해 분해되지만, 과산화수소의 농도가 지나치게 올라간 산화스트레스 상태에서는 TNPO 단백질과 이황화결합을 하여 세포핵 안으로 옮겨간다. TNPO는 FOXO를 세포질에서 세포핵막 안으로 밀어주는 특별한 운반체계이다. 세포핵 안으로 들어온 FOXO는 항산화 유전자들을 발현시킨다. 미토콘드리아에서 망간을 보조인자로 하여 슈퍼옥사이드음이온라디칼을 중화하여 과산화수소로 만드는 Mn-SOD효소 유전자의 발현이 그 한 예이다. 또한 FOXO는 앞서 살펴본 Nrf2전사인자보다 훨씬 더 그 전사범위가 넓고 다양하며 그 타깃 유전자로는 세포 주기 제어, 세포사멸(Apoptosis) 조절, DNA수리 단백질, 포도당 관련 대사조절 등이 포함된다.
3. 저산소증 유발 인자(HIF: hypoxia-inducible factor)
HIF는 저산소(Hypoxia) 상태에 대응하기 위하여 다양한 유전자를 자극하고 상향 활성화하는 전사 인자이다. 인체는 미토콘드리아 내막에서 전자 전달 사슬(ETC)을 통해 ATP를 생성하고 산화 환원 균형을 유지하는데, 만일 이 전자 전달 사슬(ETC)이 제대로 작동하지 않거나 억제된다면 H2O2의 생성이 증가할 수 있다. 저산소증은 ETC내 마지막 복합체에서 산소가 물로 환원되는 것을 방지함으로써 전자가 산소 분자(O2)와 반응하여 H2O2의 양이 증가하게 된다. H2O2의 레벨이 높은 산화스트레스 상태에서 HIF는 세포핵으로 이동하여 표적 유전자의 프로모터 부위에 위치한 특정 DNA 서열인 저산소 반응 요소(hypoxia response elements, HREs)와 결합하는 전사 복합체를 형성하고 저산소 조건을 대처하고 세포적 적응을 도모하기 위해 다양한 유전자의 발현을 증가시킨다. 혈관 생성에 관련된 유전자(주요 혈관 내피 성장 인자 VEGF), EPO와 같은 적혈구 생성 자극 인자, 무산소성 대사를 위한 당분해 효소 등의 유전자 발현을 상향 조절하여, 이들 통하여 무산소성 대사를 증가시키고, 혈관과 적혈구가 더 생성되도록 함으로써 원활한 산소공급에 기여하도록 작동한다.
4. NF-κB 경로
NF-κB (Nuclear Factor kappa B, 핵인자 요소 카파 B)는 거의 모든 세포 유형에 존재하는 전사 인자로서 면역 반응, 염증, 세포 생존 및 증식 등에서 매우 중요한 역할을 한다. NF-κB는 생리학적으로 휴지기인 상태에서는 세포질에서 비활성 형태로 존재하며, 그 억제 단백질인 IκB(inhibitors of NF‐κB)에 결합되어 엄격한 규제를 받는다. 사이토카인과 같은 염증 신호가 증가하거나 높은 H2O2로 나타나는 스트레스 상태가 되면 이 억제제가 분해되어 NF-κB가 풀려나 세포핵 안으로 이동할 수 있게 된다. 세포핵 안으로 들어온 후 특정한 DNA 시퀀스인 κB 사이트에 결합하여 유전자 발현을 조절한다.
이때, 신호 전달자로서의 H²O²는 상황에 따라 NF-κB 활성화를 자극하는 역할과 제어하는 역할을 모두 할 수 있다는 특징이 있다. 세포질에서 H²O²는 NF-κB의 억제자인 IκB 내부의 시스테인을 산화시켜 프로테아좀에서 분해되게 만듦으로써 NF-κB를 풀려나도록 돕기도 하고, NF-κB 내부의 시스테인을 산화 변형시켜 직접적으로 NF-κB에 영향을 미칠 수 있는 반면, 세포핵 내에서 H2O2 농도의 증가는 DNA의 결합을 방해하여 오히려 NF-κB의 유전자전사활동을 감소시킬 수도 있다. 이는 세포 내의 구체적 상황, 농도의 정도, 노출 시간등의 여러 요인에 따라 달라질 수 있다고 한다.
대표적 ROS인 H2O2가 세포 내에서 신호전달물질로서 역할하는 것을 몇 가지 살펴보았다. 슈퍼옥사이드라디칼은 H2O2에 비해 상대적으로 막을 통과하기 힘들고, 수산화라디칼은 반응성이 너무 커서 신호기능을 수행할수 없기때문에 보다 안정적이고 막 투과성이 더 높은 과산화수소가 일반적으로 가장 주요한 신호 ROS로 간주된다. 물론 슈퍼옥사이드라디칼이 MAPK/ERK 경로를 활성화하여 다양한 세포에서 성장신호로 작용하고, 일중항산소 역시 여러 신호전달 경로를 매개하고 프로그래밍된 세포사멸을 촉진할 수도 있다는 보고도 있으나 ROS의 특성상 감지 기술의 한계로 아직 모호한 부분이 많아 다양한 ROS들의 생리학적 신호전달에 대한 더 많은 추가 연구가 필요할 것이라고 한다.
[참고자료]
Redox signaling at the crossroads of human health and disease
https://www.ncbi.nlm.nih.gov/pmc/articles/PMC8971743/#mco2127-bib-0006
An overview of mechanisms of redox signaling
https://www.ncbi.nlm.nih.gov/pmc/articles/PMC4048798/
Signaling Functions of Reactive Oxygen Species
https://www.ncbi.nlm.nih.gov/pmc/articles/PMC4226395/
Redox Signaling, Vascular Function, and Hypertension
https://www.ncbi.nlm.nih.gov/pmc/articles/PMC2828811/
Reactive oxygen species or reactive sulfur species: why we should consider the latter
'활성산소(ROS)관련' 카테고리의 다른 글
| ROS: 항산화효소: 글루타티온 퍼록사이드(GPx)와 카탈라제(Catalase) (0) | 2024.03.10 |
|---|---|
| ROS: 자유라디칼은 필요악(necessary evil)인가. (0) | 2024.03.10 |
| ROS: 활성산소 생산이 목적인 호흡폭발(Respiratory burst) (0) | 2024.03.10 |
| ROS: 활성산소는 어디서 만들어지는가 (0) | 2024.03.10 |
| ROS: 가장 강력한 라디칼: 수산화라디칼(ft 지질과산화) (1) | 2024.03.10 |