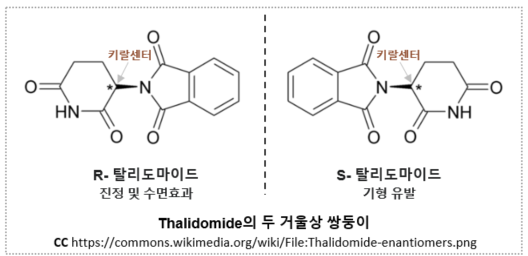
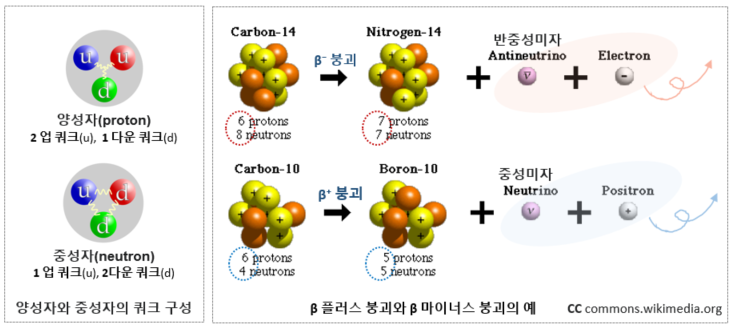
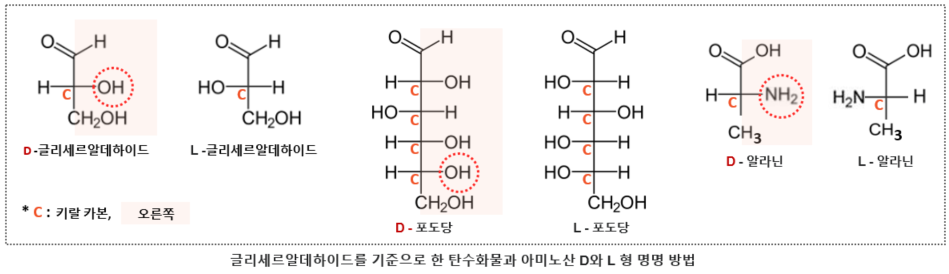
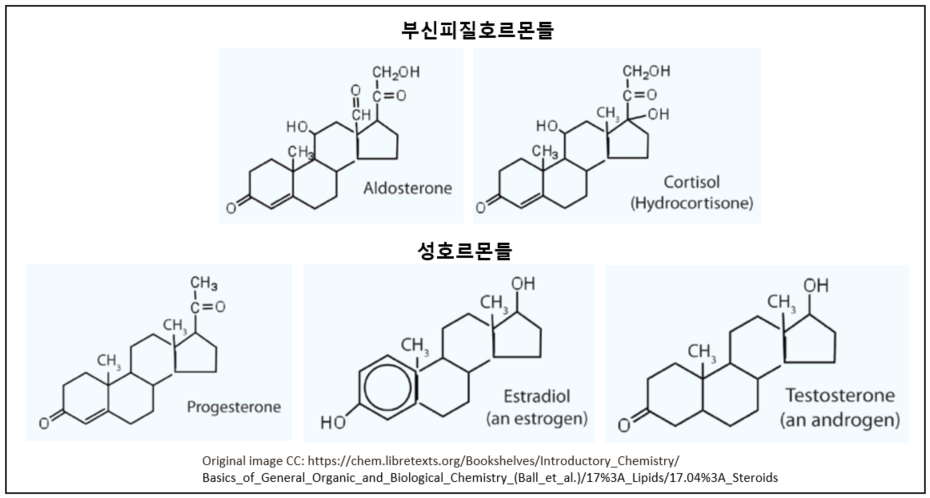
약물이 체내로 들어오면 동일한 세포 내 신호 전달 경로를 거치면서 작동하겠지만 개인별로 대사 능력과 각 대사 기관의 상태가 다르므로 특정 환자에게 있어 투약량이나 투약간격등이 달라져야 약물의 효과를 가장 안전한 방법으로 최대한 끌어올릴 수 있을 것이다. 키랄 약품이 라세미체로 합성된다는 점은, 도움을 받기 위해 누군가를 초대했는데, 그 손님이 내 허락도 없이 누군가를 함께 데리고 들어온 것 같은 불편한 상황으로, 그 함께 따라 들어온 불청객이 나에게 어떤 영향을 미칠지 가늠할 수 없다면 처음부터 그 불청객을 달고 들어오지 않는 것이 최선일지도 모른다. 특히 약물 섭취를 최대한으로 줄이고 싶어 하는 사람들이 무척이나 피하고 싶을 반갑지 않은 상황임이 분명하다. 잠시 잠깐 복용하는 약이 아니라, 장기적으로 ..