항산화 네트워크
버클리대 생화학교수 Lester Packer는 평생을 항산화제 연구에 헌신하며 항산화제와 건강과 관련된 800개의 과학 논문과 100권 이상의 책을 집필하여 "항산화제 박사"라고 불리었다. [1] 처음으로 비과학자들을 대상으로 쓴 그의 책, "The Antioxidant Miracle"에서 그는 항산화제들이 인체 내에서 각각 개별적으로 활약하는 것이 아니라, 서로 상호 간에 시너지효과를 위해 네트워크화되어 작동하며, 가장 중요한 점은 이 항산화 네트워크를 통하여 항산화제들이 서로가 서로를 재생시킨다고 하는 "항산화 네트워크" 개념을 소개했다. 전체로서의 네트워크가 질병으로부터 우리를 보호하고 노화를 늦추는 "기적"이란 것이다.
우리가 잘 알고 있듯이, 전자를 잃고 날뛰는 라디칼을 무장해제시키기 위해 항산화제들은 기꺼이 자신의 전자를 내어줌으로써 라디칼의 폭주를 막는다. 그러나 이 정상적인 항산화 과정에서 전자를 내어준 항산화제 역시 미약하지만 스스로도 라디칼화되는 것을 피할 수 없다는 것이다. 물론 본인이 무장해제시킨 그 라디칼보다야 훨씬 덜 해롭고 약하여 큰 부작용을 일으키지는 않겠으나 그래도 라디칼은 라디칼이다. 따라서 본연의 임무를 다한 항산화제를 다시 환원시켜 원래의 항산화제의 위치로 복귀시켜 줄 수는 있는 도우미가 필요하다. 항산화제를 항산화시켜 줄 다른 항산화제. 바로 항산화제 재생 네트워크라 할 수 있겠다. 비타민C가 산화되면 글루타티온이 이를 환원시켜 주고, 글루타티온이 산화되면 리포산이 이를 환원시켜 주고, 리포산이 산화되면 코엔자임큐텐이 이를 환원시켜 주고, 코큐텐이 산화되면 비타민 E가 환원시켜 주고, 산화된 비타민E는 비타민C가 환원시켜 준다.
Packer교수는 리포산을 특히 리포산을 중추적 역할을 하는 항산화제로 꼽았는데, 리포산은 네트워크상의 다른 항산화제를 재생시킬 뿐만 아니라 스스로도 재생시킬 수 있기 때문이다. 또한, 비타민C와 글루타티온은 수용성으로 세포질 내에 존재하고, 비타민E와 코큐텐은 지용성으로 세포막에 존재하는 반면, 리포산은 수용성과 지용성 성격을 모두 갖고 있어 그 활동범위가 훨씬 넓다.
먼저, 네트워크 체제를 고찰하기 전 각각의 항산화제들을 간략히 살펴보자
글루타티온(Glutathione)
글루탐산, 시스테인, 글리신의 3가지 아미노산의 합성으로 이루어진 것으로, 시스테인의 황과 수소로 이루어진 sulfhydryl groups (-SH기, 보통 thiol기라고도 한다)가 산화환원작용이 일어나는 중요한 부위이다. 글루타티온은 혈액에는 거의 없고 대부분 세포 내에 존재한다. 수용성 환경에서 잘 작용한다. 환원형(일반상태)인 GSH와 산화형인 GSSG로 존재하는데, 건강한 세포 및 조직에서는 GSH가 90% 이상을 차지하고, 산화/ 환원 형태 간의 비율을 통해 산화스트레스를 가늠하기도 한다. 정상적인 세포 상태에서는 GSH:GSSG 비율이 100:1이나 산화스트레스가 심하면 1:1까지도 떨어질 수 있다.
글루타티온의 4가지 대표적 기능
1. 항산화작용: 앞선 글들에서 살펴본 항산화효소작용에서 보았듯이 GPx항산화 촉매효소에서 사용된다. 항산화제 중 가장 강력한 것으로 인정되며, 산화가 된 후에도 독성이 거의 없다는 장점을 가진다. 또한 항산화작용을 하는 비타민C와 비타민E가 산화되었을 때 이들을 환원시켜 다시 항산화 활동을 할 수 있도록 재생시키는 중요한 역할을 한다.
2. 해독효과: 글루타티온은 포름알데하이드(formaldehyde)나 염소가스(chlorine gas) 등의 유독성 화학 물질, 납 카드뮴(cadmium) 수은 등의 중금속, 약물의 대사산물, 오염물질등의 체내로 유입된 유해 화합물과 킬레이트 결합하여 전이효소(Glutathione-S-transferase)를 통하여 담즙과 대변으로 안전하게 체외배출시켜 해독하는 강력한 해독제 기능을 한다. [2]
3. 면역력 증강 효과: T세포를 성숙시키고 활성화시켜 면역 기능 증강.
4. 지방을 태우는 효과를 증가: 미토콘드리아에서 지방산의 산화를 조절하고 지방연소를 향상시켜 에너지 생성을 증가시킨다.
세포건강증진과 해독을 도와주는 기능으로 신경퇴행성 질환, 폐질환, 면역질환, 심혈관 질환, 간 질환, 등에 치료약으로서는 아니라도 임상적으로 큰 도움을 주는 성분으로 활용되고 있다. 산소소모량이 다른 장기보다 훨씬 높은 뇌의 경우 활성산소의 공격에 취약하기 때문에 뇌의 건강유지에 글루타티온이 매우 중요하다.
알파리포리산(Alpha Lipoic Acid: ALA)
ALA는 탄소수 8개(C8H14O2S2)의 유기황화합물이다. 에너지 대사에서 중요한 보조효소로 작용한다. TCA회로 내에서 탄소가 하나 떨어져 나가고 coA를 결합하는 두 개의 과정, 즉 피브루산을 acetyl coA로 전환시키는 피루브산탈수소효소복합체(Pyruvate Dehydrogenase Complex)와 알파-케토글루타르산(α-Ketoglutaric acid)을 석시닐-coA (Succinyl-coA)로 전환시키는 알파-케토글루타르산 탈수소효소 복합체 (α-Ketoglutarate dehydrogenase complex)의 보조효소 중 하나이다.
항산화제로서의 ALA는 항산화네트워크 내의 모든 항산화제를 재생시킬 수 있을 뿐만 아니라 스스로도 재생시킬 수 있기 때문에 항산화 네트워크에서 중추적인 역할을 한다. 이에 더해 다른 항산화제와 달리 수용성과 지용성의 성격을 모두 갖고 있어 보다 광범위한 세포에서 작용할 수 있다는 점에서 유니버설 antioxidant라고도 불린다. ALA는 미토콘드리아에서 소량으로 매일 생성되어 인체의 모든 세포에 존재하는 유기황화합물이다.

고혈당증으로 인한 산화스트레스는 신경세포의 프로그램된 사멸을 야기하여 당뇨병성 신경병증(Diabetic nephropathy)을 발병시키는데 이때 ALA를 경구투여할 경우 신경병증의 증상이 개선된 것으로 보고되고 있다. [3] 실험적 당뇨병 신경병증에서 ALA은 운동신경의 전도속도를 향상하고, 신경 성장 인자를 자극하고 섬유 재생 촉진과 같은 작용도 하는 것으로 나타났다.
또한 주목할 점은 ALA를 치료에 이용할 경우, 생체내 환원형 글루타티온 GSH를 증가시킨다는 것인데 이는 Packer교수의 연구에서도 ALA이 글루타티온 수치를 최대 30% 정도까지 끌어올릴 수 있다고 발표했다고 한다. [4]
ALA는 뛰어난 항염증 역할로도 잘 알려져 있는데, 대사증후군 및 이와 관련된 질병을 갖고 있는 환자들을 대상으로 한 메타분석에서 ALA 보충제를 투입했을 때 인터루킨 6(IL-6 )과 종양 괴사 인자 알파(TNF-α) 등의 염증성 사이토카인과 CRP(C-reactive protein: 염증상태를 파악할 수 있는 단백질)와 같은 염증을 표시하는 마커들이 감소한 결과가 나왔다. 이는 ALA이 CRP수준을 크게 감소시켜 사이토카인 생성을 전사하는 핵 인자 κB(NF-κB)의 신호 계통이 과다하게 활성화되는 것을 방지함으로써 염증을 감소시키는 것으로 보인다. [5]
비타민 E
인체 내에서 8개의 형태로 존재하지만 알파토코페롤(alpha-tocopherol)이 가장 보편적인 형태로서 생체이용률이 가장 높다. 지용성 항산화 성분으로 가장 중요한 기능은 세포막 인지질 등의 지방산화를 막는데 큰 역할을 한다는 것이다. 지질과산화반응에서 일어나는 라디칼에 의한 연쇄반응의 확산을 끊어 종결시키는 지방과산화의 1차 방어 항산화제이다. 이를 통해 혈액과 조직의 지질을 보호하고 저밀도 지단백질(LDL)의 산화를 방지해 줌으로써 심혈관계에 매우 중요한 영향을 미치는 항산화제이다. 콜레스테롤이 산화되어 덩어리가 만들어지면 심장마비와 뇌졸중을 일으킬 수 있다. 앞선 글들에서 지방과산화가 지속될 경우 지질을 포함한 세포들에 미치는 악영향과 치명적인 알데하이드 생성에 대해 고찰해 보았다.
비타민 E는 T림프구와 항원제시세포(APC) 사이의 접착 접합(면역 시냅스로 알려짐)의 형성을 개선하는 것으로 밝혀졌으며, 이는 결국 T세포 활성화 및 증식을 촉발하여 면역에 영향을 미치기도 한다. [6]
Vitamin E는 각종 라디칼에 대항하여 반응속도가 일정하면서도 매우 빠르게 작용하여 아주 소량으로도 생체내에서 엄청난 양의 과산화라디칼생성에 대항할 수 있다.
참고로, 2008년에 코펜하겐 대학병원 연구팀이 비타민A, E, 베타카로틴등의 항산화 비타민들을 함께 복용 시 평균 5% 이상 사망률이 증가되었다는 연구결과를 발표해 의학계가 혼란에 빠졌었다. 일명 ‘코펜하겐쇼크’로까지 불리었던 이 보고서는 이후 많은 논쟁이 있었으나, 아직 확정적인 결론을 도출하는 데는 한계가 있는 듯하다. 저자들은 본 보고서의 업데이트 글에서 항산화 보충제는 의약품으로 간주되어야 하며 시판 전에 충분한 평가를 거쳐야 한다고 결론지었다. [7] 다행히도 지용성 비타민은 인체에 일정 기간 체류하는 편이고, 이를 감안할 때 굳이 보충제로 보충하지 않아도 식품을 통해 섭취해도 충분하다는 의견들도 있다. 성인 기준 하루권장량(RDA)은 15mg이고 올리브유, 해바라기씨, 땅콩, 아몬드, 등에 많이 함유되어 있다. [8]
지질과산화와 비타민 E, 그리고 비타민C
이제 비타민E의 가장 중요한 기능인 항산화역할, 특히 지용성 비타민으로써 지질과 관련된 항산화에서 독보적인 역할을 하는 것으로 대단히 중요성을 가지는 바, 그 작용 기전을 좀 더 살펴보자.
인체를 이루고 있는 세포에는 막(membrane)이 있다. 막의 기능은 통과해도 되는 물질과 통과해서는 안될 물질을 구별하여 선택적으로 통과를 허용하기 위한 안전장치이다. 세포의 안과 밖을 나누는 세포막을 비롯하여 세포 내 소기관의 외부 경계와 세포핵을 둘러싸는 막, 그리고 점막이나 장막과 같은 조직의 막도 있다. 적혈구도 막을 가진다. 이러한 생체막은 2개의 지방산과 1개의 인산기가 결합된 인지질로 만들어진다. 인지질은 이중층으로 구성되는데, 지방산으로 이루어진 물을 싫어하는 꼬리 부분은 안쪽으로 말려 들어가 있고(아래 그림의 녹색 부분), 물과 친한 인산기로 된 머리 부분(아래그림의 핑크 부분)은 바깥쪽을 향하여 물과 접하고 있다.

이 생체막이 라디칼을 공격을 받으면, 즉 더 자세히 말해 생체막을 이루는 인지질의 꼬리 부분 불포화지방산의 탄소 이중결합지점 메릴린 브리지(methylene bridge)가 산화되면 지질과산화가 촉발된다. 이러한 지질에 대한 라디칼의 공격은 연쇄반응이라는 무서운 현상을 야기시켜 세포막에 상당히 심각한 손상을 일으킬 수 있는데 이를 방지하기 위해 대표적 친지방 항산화제인 비타민E(주로 α tocopherol)가 지질 라디칼에게 자신의 전자를 주고 스스로 산화하여 자신은 비타민 E 라디칼(α tocopheryl radical)로 산화한다. 이렇게 중요한 비타민E의 끊임없는 항산화활동을 보장하기 위해 필요한 것이 바로 비타민C이다. 비타민C가 산화된 비타민E를 다시 원래대로 환원시켜 재생시킨다. 비타민 E의 토코페롤 페놀기가 생체막의 물과 가까운 부분에 위치하기 때문에 친수성 비타민C가 이 토코페롤의 항산화 활성 부위에 쉽게 접근하여 토코페롤 라디칼을 제거하고 다시 토코페롤 상태로 재생시킬 수 있다. [9] 라디칼의 공격을 받는 세포막에 비타민 C를 비타민 E와 함께 투입하면 흥미롭게도 비타민 C가 다 고갈될 때까지는 비타민E의 양이 변하지 않다가 비타민C가 고갈되고 나면 그때서야 그 양이 줄어드는 연구결과를 통해 이들 간의 이러한 시너지관계를 알 수 있다. [10]
지질(LH)이 라디칼화(L˚)된 후 주변의 지질(LH)을 또다시 공격하여 지질퍼옥시라디칼(LOO˚)을 생성하는 전파단계를 비타민E가 전자를 내어주면서 종결시키는 과정을 도식으로 간단히 살펴보면 다음 그림과 같다. (파워포인트는 손가락이 뚱뚱한 사람들이 작업하기엔 참... ) 비타민E를 재생시키며 산화된 비타민C의 환원 과정은 아래에서 살펴본다.

비타민 C(Ascorbic acid)
수용성 성분인 비타민C는 세포의 안과 밖 모두에서 작용하여 라디칼을 중화한다. 뇌와 부신의 카테콜아민 생합성에서 도파민을 노르에피네프린으로 전환할 때도 필요하고, 면역 체계의 구성요소 개선에도 관여하는 등 수많은 생화학적 과정에 참여하는 필수 영양소이다. 콜라겐을 합성에도 필수적인데 비타민C를 통해 프롤린(proline) 잔기를 hydroxyproline로 산화시켜야 콜라겐 전구체인 프로콜라겐이 콜라겐으로 전환된다. 그러나 인간을 포함한 몇몇 고등 영장류들은 진화하는 과정에서 체내에서 비타민C를 합성하는데 필요한 효소를 발현하는 유전자가 돌연변이로 비활성화되어 체내합성을 할 수 없게 되어 반드시 외부로부터 흡수해야만 한다.
항산화제로서 매우 중요한 역할을 하는 비타민C는 먼저, 일중항산소의 1O2제거에 탁월하다. 글루타티온보다 100배 정도 더 빠른 속도록 제거할 수 있으며, 특히 SOD 등을 비롯한 ROS전문 제거효소가 부재한 세포핵과 게놈 DNA 근처에서 비타민C의 항산화 역할을 매우 중요하다한다.
비타민C의 산화환원반응
비타민C는 한 번에 하나의 전자만 라디칼에 공여한다. 비타민C는 보통 2단계에 걸쳐 산화화는 데, 먼저 양성자하나와 전자하나를 라디칼에 넘겨주고 Monodehydroascorbate radical( (또는 Ascorbate radical, Semidehydroascorbic acid)로 1차 부분 산화된 후, 다시 같은 과정을 반복하여 Dehydroascorbic acid로 완전 산화한다. 이때 각각의 환원효소에 의해 이전 단계로 환원된다. (아래 그림 참조) Dehydroascorbic Acid를 비타민C로 환원시키는 환원효소는 반드시 글루타티온(GSH)이 필요하다.
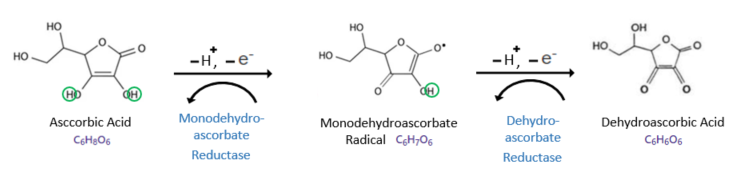
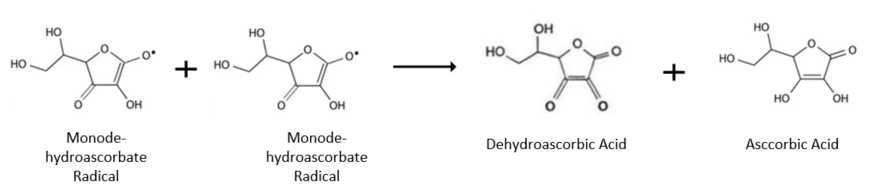
생리적 조건 하에서 Monodehydroascorbate radical 은 그 환원효소에 의해 다시 환원되지만, 만일 이 환원효소가 없다면 두 개의 Monodehydroascorbate radical이 서로 반응하여 촉매의 도움 없이 자연스럽게 불균등반응을 하게 되는데, 그 결과로 하나의 Ascorbic Acid와 하나의 Dehydroascorbic Acid를 생성한다. 이들 역시 위의 그림에서 나타난 환원경로를 갖는다.
비타민C는 대부분 나트륨(Sodium) 의존성 비타민 C 수송체(SVCT)를 통하여 장으로부터 흡수되지만, 세포 내로 유입될 때에는 반드시 산화형태인 Dehydroascorbic acid의 형태로 포도당 수송체인 Glut1을 통해 들어온 후, 세포 안에서 다시 이를 ascorbic acid로 환원시켜 산화스트레스로부터 미토콘드리아 등을 보호한다. 비타민C(C₆H₈O₆)와 포도당(C₆H₁₂O₆)의 화학식은 흥미롭게도 매우 유사하다.
Coenzyme Q10
지용성인 CoQ10은 다양한 이름으로 불린다. 코엔자임(Coenzyme)은 효소의 촉매활동을 돕는 보조인자를 의미하고, Q는 방향족화합물의 벤젠고리에서 수소 2개가 산소 2개로 치환된 화합물을 총칭하는 Quinone을 의미한다. 10은 이소프렌(isoprene)이라는 하위 화학 단위가 꼬리 부분에서 10번 반복되기에 붙은 것이다. 모든 세포의 어디에나 존재한다는 것을 나타내기 위해 Ubiquitous를 따서 유비퀴논이라고도 부른다. 비타민K와 그 화학구조가 유사하고 비타민의 일반적인 정의에 적합하여 비타민 Q라고도 불리지만 인체 내에서 합성되기 때문에 비타민이라고 간주할 수 없다고 한다.
에너지 대사(ATP 합성) 과정인 전자전달계의 중요한 일부분을 담당하고 있기 때문에 에너지를 많이 필요로 하는 심장, 간, 신장들에서 특히 고농도로 존재한다. 전자를 2개씩 전달하는 NAD나 FAD와 같은 다른 조효소와 달리 한 번에 전자를 한 개씩 전달할 수 있는 고유한 특징으로 전자전달계에서 꼭 필요한 요소이다.
3가지 형태의 CoQ10
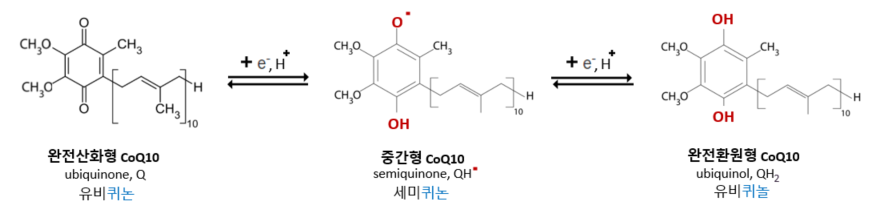
산화형인 유비퀴논형태 CoQ10은 각각 전자 하나와 양성자를 받아 세미퀴논으로 부분 환원되고, 다시 전자 하나와 양성자를 받아 유비퀴놀로 완전 환원된다.
항산화 작용과 관련된 CoQ10의 활동을 살펴보자면 먼저, 친유성 항산화제인 유비퀴놀은 비타민E처럼 지질과산화 과정에서 지질퍼옥시라디칼(LOO˚)에 전자를 내어 주어 라디칼을 제거시킨다.
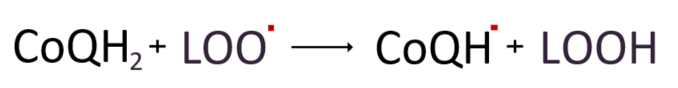
또한 항산화활동으로 산화된 비타민 E를 재생시킬 수도 있다.
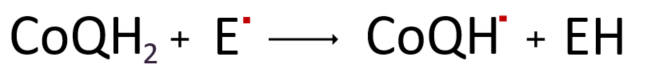
위와 같은 항산화 과정에서 전자를 내어주고 산화한 세미퀴논(CoQH˚)은 앞서 언급한 에너지 대사과정인 전자전달계에서 이동 중인 전자를 받아 유비퀴놀로 다시 재생되어 항산화 활동을 개시한다.
보충제
연령에 따라 체내 생합성률이 현저히 떨어진다는 점과, 지속적으로 스타틴(Statin)을 복용하는 환자들의 경우 별도의 보충이 권장된다고 한다. [11] 고지혈증 환자들에게 처방되는 스타틴 계열 약품들은 HMG-CoA reductase 효소를 억제하여 콜레스테롤의 생성을 감소시키는 기전을 갖는데, 문제는 같은 경로를 통해 생성되는 coQ10의 양도 함께 감소하는 부작용이 야기될 수 있기 때문이다.
위에서 살펴본 항산화제 간의 상호작용을 그림으로 나타내면 다음과 같다.

[참고자료]
[1] LESTER PACKER, PH.D.
https://www.nuskin.com/content/dam/nse/pdf/Bios/lesterpacker.pd
[2] The role of glutathione in detoxication
https://www.ncbi.nlm.nih.gov/pmc/articles/PMC1569131/pdf/envhper00455-0063.pdf
[3] Alpha-Lipoic Acid and Diabetic Neuropathy
https://www.ncbi.nlm.nih.gov/pmc/articles/PMC2836194/
[4] Review: The Antioxidant Network
https://www.lifeextension.com/magazine/1999/8/report5
[5] The effects of alpha-lipoic acid supplementation on inflammatory markers among patients with metabolic syndrome and related disorders: a systematic review and meta-analysis of randomized controlled trials
https://www.ncbi.nlm.nih.gov/pmc/articles/PMC5989440/
[6] Vitamin E
https://lpi.oregonstate.edu/mic/vitamins/vitamin-E
[7] Antioxidant supplements for prevention of mortality in healthy participants and patients with various diseases
https://www.ncbi.nlm.nih.gov/pmc/articles/PMC8407395/
[8] Vitamin E
https://ods.od.nih.gov/factsheets/VitaminE-HealthProfessional/
[9] An Overview of the Characteristics and Function of Vitamin C in Various Tissues: Relying on its Antioxidant Function
https://brieflands.com/articles/zjrms-4037
[10] Lipid antioxidants: how they may act in biological systems.
https://www.ncbi.nlm.nih.gov/pmc/articles/PMC2149475/
[11] Coenzyme Q10: Regulators of Mitochondria and beyond
https://www.intechopen.com/chapters/71878
'활성산소(ROS)관련' 카테고리의 다른 글
| ROS: 활성산소에 대한 나의 정리 (0) | 2024.03.10 |
|---|---|
| ROS: 항산화효소: 글루타티온 퍼록사이드(GPx)와 카탈라제(Catalase) (0) | 2024.03.10 |
| ROS: 자유라디칼은 필요악(necessary evil)인가. (0) | 2024.03.10 |
| ROS: 신호전달물질로서의 ROS (1) | 2024.03.10 |
| ROS: 활성산소 생산이 목적인 호흡폭발(Respiratory burst) (0) | 2024.03.10 |