인산의 화학적인 측면
이제 화학적 측면에서 인을 조금 더 알아보자. 인은 생체내에서 인산(H3PO4)으로 존재한다. pH와 같은 다양한 환경에 영향을 받아 수용액 상태에서 인산은 수소양성자를 각각 하나씩 잃어 3가지 형태로 존재할 수 있다.

위와 같이 하나의 인산이 여러 형태로 존재할 수도 있고, 하나 이상의 인산들이 결합할 수도 있다. 인산들이 두 개 또는 세 개가 결합하여 이인산과 삼인산을 만든다. 아래 이미지에서는 모두 수소양성자가 그대로 모두 결합되어 있는 상태이다. 즉 아래 그림에서 수소들을 잃으면 위 그림에서 볼 수 있는 인산염의 모양이 된다.

에스터결합(Ester bond)
이 시점에서 화학에서 에스터(ester)화 반응이라는 것을 잠깐 살펴볼 필요가 있다. 에스테르라고도 읽는 에스터는 산과 알코올이 반응하여 만들어지는 화합물을 말한다. 화학에서 말하는 알코올(개인적으로 듣기만 해도 기분이 좋아지는 화합물이다)이란 것은 탄소사슬의 수소가 수산기 즉, 하이드록실기(OH)로 대체되어 있는 유기 화합물(R-OH)을 말한다. 아주아주 간단히 생각하자면, 탄소에 OH기가 붙은 것이라고 볼 수 있다.
가장 대표적인 산이라고 할 수 있는 카르복실산(R-COOH)을 예로 들어보자면, 카르복실산과 알코올이 만나면, 에스터 화합물(RCOOR')과 물(H2O)이 생성된다. 유기화합물의 나머지 탄화수소 부분을 R과 R'(아래 그림에서는 R1과 R2)로 나타낸다고 했을 때 ester 화합물 생성을 아래 그림과 같이 간략하게 표현할 수 있다. 카르복실기의 수소와 알코올화합물의 수산기 OH가 만나 물이 되어 빠져나오면서 두 분자가 결합한 것이다. 참고로 이 과정처럼 두 분자가 반응하여 물 한분자를 만들면서 결합하는 것을 탈수 축합(condensation) 반응이라고 한다.

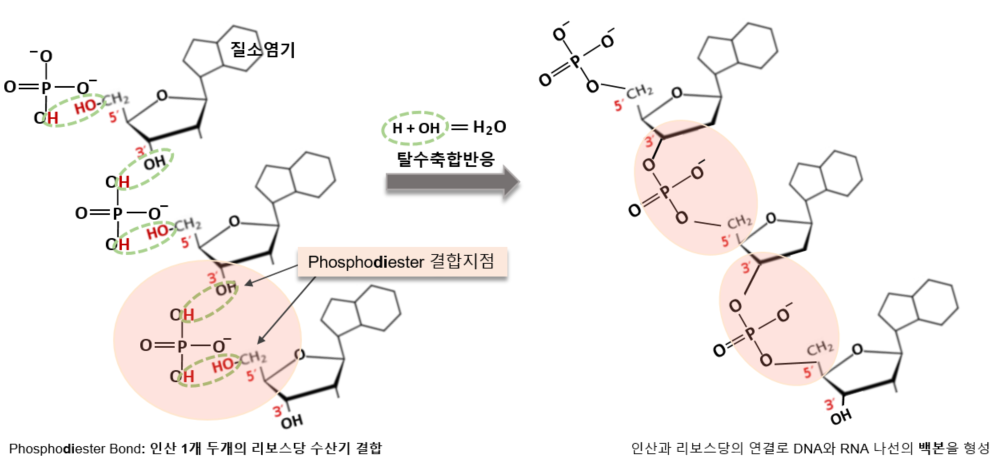
이 에스터 결합에 카르복실산이 아닌, 인산을 대입해 보자. 탄소대신 그 자리에 인을 넣어 R1-POO-R2의 결합형태가 되고 우리는 이것을 인산에스터결합(phospho-ester bond)이라고 부른다. 아래 그림에서 처럼, 하나의 인산안에 수산(하이드록실)기 2개가 두 개의 당 분자의 수산기와 각각 하나씩 공유 결합하는 것을 인산디에스터결합(Phosphodiester Bond)한다. 중간의 ‘di-’는 2를 뜻하므로 두 개의 에스터 결합을 의미한다. 이 결합을 통해 DNA와 RNA의 바깥 나선형 중추가 이루어진다. 아래의 그림은 인산이 위와 아래의 리보스당 3번과 5번에 연결된 것을 보여준다. 결합 시 물을 내보내며 에스터 결합이 일어난 것이다.
Phosphodiesterase(PDE)
물론, 이러한 결합을 반대로 끊어내는 효소도 있다. 인산과 수산기 사이에서 물이 나오면서 결합이 이루어진 것처럼, 거꾸로 Phosphodiester 결합을 분해하기 위해 물을 투입하여 반응시킨다. Phosphodiesterase(PDE)라는 가수분해 효소이다. 가장 대표적 세포 신호 전달 체계인 G단백질 결합 수용체(GPCR)를 통한 신호 체계에서 외부의 신호를 이어받아 세포 내 2차 신호메신저로 중추적 역할하는 고리형 아데노신 일인산(Cyclic adenosine monophosphate: cAMP)과 고리형 구아노신 일인산(Cyclic guanosine monophosphate: cGMP)의 적절한 양을 조절하는 기능을 한다. 이 효소는 너무 많은 cAMP와 cGMP가 세포내 존재할 경우 이들을 분해하여 과다한 축적을 방지한다. 자세한 내용은 세포 내 신호전달 경로와 관련된 GPCR부분을 참조하기로 한다. 인산의 이러한 에스터결합은 뒤에서 다룰 특정 아미노산의 인산화과정에서 다시 보게 된다.
인산화(phosphorylation)란?
단백질과 인산의 화학적 측면을 살펴보았으니 이제 인산화에 대하여 알아보자. 인산화는 단백질 합성이 완료된 후에 행해지는 가장 보편적인 수정방법이다. 인산화는, 간단히 말하자면, 어떤 물질에 인산을 붙이는 것을 말한다. 인산을 단백질에 붙이면 어떤 일이 일어나는 걸까? 우리는 단백질의 입체구조가 그 기능을 규정함을 잘 알고 있다. 인산은 2개의 음전하를 띠고 있기 때문에 인산이 단백질과 결합할 때, 단백질의 음전하를 띠는 부분과 접하게 되면 그 부분은 서로를 밀어낼 것이고 양전하를 가진 부분과 접하게 되면 끌어당기게 될 것이다. 결국 이러한 정전기적 인력과 반발력은 이 단백질의 형태를 틀어지게 만들 것이고 이러한 구조의 변화는 곧 단백질 기능을 변화를 야기하는데, 만일 이 단백질이 효소라면 그 활성이 증가할 수도 감소할 수도 있고, 이 단백질이 수송단백질이라면 그 수송능력에 변화를 가져올 것이다. 그 외에도 단백질의 안정성이나 성질도 변화시킬 수 있다. 단백질이 인산화되어 핵으로 진입할 수 없게 되면 유전자발현이 불가능 해질 것이다. 단백질의 인산화는 타 단백질을 비롯하여 지질, DNA, RNA와 같은 다른 분자들과의 상호작용에도 변화를 일으킬 수 있다. 음전하를 띠는 인산을 수 차례에 걸쳐 계속해서 결합하게 된다면 이러한 변화는 더욱 다양하고 심화되어 나타날 것이다.
세포는 타깃이 되는 단백질을 인산화하여 분자들의 활동을 활성화, 즉 스위치 온 시키기도 하고, 비활성화시켜 꺼버릴 수도 있으며, 또한 활성 상태을 증진시키기도 하고 억제시키도 하면서 활성의 속도와 양도 조절할 수 있다. 한마디로 인산화는 세포가 여러 과정들을 통제하고 조절할 수 있는 제어수단이다. 세포 내 유전자 발현, 세포 증식, 분화, 세포 사멸, 신호 전달, 면역 조절, 대사조절 등이 모두 세포가 매일매일 행하는 과정들이다. 세포 내 신호전달에서 더 자세히 보겠지만, 인산화는 하나의 인산화된 단백질이 그다음 단계의 단백질을 인산화하고, 다시 그 단백질이 그 하위 단백질을 인산화하는 단계적 과정, 즉 위에서 폭포물이 아래로 흘러내려가는 형태의 cascade형태를 띠는 경우가 많다. 또한, 인산화는 외부에서 들어온 작은 하나의 신호가 세포 내에서 엄청나게 많은 양의 신호로 증폭되는 것을 가능하게 하기도 한다.
이러한 고도의 제어수단에 어느 한 단계에서라도 문제가 생긴다면 그 결과 또한 치명적일 수 있다. 우리는 인산화 과정의 결함으로 인해 신호전달 경로에 이상이 생기게 되어, 암을 비롯하여 각종 염증성 질환, 신경 질환, 신경퇴행성질환과 같은 여러 심각한 질병들이 발병할 수 있음을 짐작할 수 있다. 여러 암에 대한 연구에서 특정 단백질의 인산화효소가 비정상적으로 발현된 것이 발견된다고 한다. 따라서 암을 치료하기 위한 여러 연구에서 단백질의 인산화는 중요한 연구 대상이 되는 것이다.
탄수화물, 지질, 단백질 모두가 인산화의 타깃이 될 수 있으나, 이 글에서는 특히 단백질 인산화를 다루고자 하므로 이 맥락에서 인산화가 일어나는 대상 물질, 즉 기질(substrate)은 단백질이 된다. 더 정확히 말하자면, 아미노산 곁사슬에 인산기를 공유 결합시킨다. 앞 글에서 간략히 단백질의 기본 구조를 살펴보았는데 모든 아미노산이 공통적으로 갖고 있는 백본에 붙어있는 곁사슬 중 주로 세린(Ser), 트레오닌(Thr) 및 티로신(Tyr)에서 인산화가 일어난다. 다만, 아르기닌(Arg), 라이신(Lys), 히스티딘(His), 시스테인(Cys), 아스파르트산(Asp) 및 글루타민(Glu) 잔기에서도 화학적으로 인산화가 가능하다고 하지만 [1] 흔히들 인산화를 말할 때 세린, 트레오닌, 티로신만을 다루는 이유는 이들이 차지하는 비율이 각각 86.4%, 11.8% 그리고 1.8%로서 거의 대부분을 차지하기 때문이다. [2]
이들 3개의 아미노산은 공통적으로 수산기(OH)를 그 잔기에 갖고 있다. 위에서 살펴본 에스터반응을 다시 상기해 보자. 이 들 수산기의 수소자리에 인산이 들어가 결합하는 것이다. 아래 그림은 세린에 인산 그룹이 결합할 때 세린의 수산기가 인산으로 대체되며 인산화된 세린 즉, 포스포세린이 되는 것을 보여준다.

이제 다음글에서 인산화를 촉매 하는 효소, 키나아제에 대해 살펴보자.
[참고 자료]
[1] Why nature chose phosphate to modify proteins
https://www.ncbi.nlm.nih.gov/pmc/articles/PMC3415839/
[2] Protein posttranslational modifications in health and diseases: Functions, regulatory mechanisms, and therapeutic implications
https://www.ncbi.nlm.nih.gov/pmc/articles/PMC10152985/
'세포생물학 > 생화학' 카테고리의 다른 글
| 키랄성 1: 거울에 비친 쌍둥이 이미지, 손의 속성, 키랄성(chirality) (1) | 2025.01.13 |
|---|---|
| 이소프렌, 테르펜, 이소프레노이드, 테르페노이드 그리고 콜레스테롤. (1) | 2024.10.25 |
| 키나아제4 : kinase의 구분 및 구조(PKA) (0) | 2024.07.28 |
| 키나아제2 : 단백질 번역후 수정방법과 단백질 인산화 (0) | 2024.07.28 |
| 키나아제1 : 인(P, Phosphorus), 인산 (0) | 2024.07.28 |