약물이 체내로 들어오면 동일한 세포 내 신호 전달 경로를 거치면서 작동하겠지만 개인별로 대사 능력과 각 대사 기관의 상태가 다르므로 특정 환자에게 있어 투약량이나 투약간격등이 달라져야 약물의 효과를 가장 안전한 방법으로 최대한 끌어올릴 수 있을 것이다. 키랄 약품이 라세미체로 합성된다는 점은, 도움을 받기 위해 누군가를 초대했는데, 그 손님이 내 허락도 없이 누군가를 함께 데리고 들어온 것 같은 불편한 상황으로, 그 함께 따라 들어온 불청객이 나에게 어떤 영향을 미칠지 가늠할 수 없다면 처음부터 그 불청객을 달고 들어오지 않는 것이 최선일지도 모른다. 특히 약물 섭취를 최대한으로 줄이고 싶어 하는 사람들이 무척이나 피하고 싶을 반갑지 않은 상황임이 분명하다. 잠시 잠깐 복용하는 약이 아니라, 장기적으로 꾸준히 복용해야 하는 약물이라면 더욱 그렇다. 하지만, 최근의 미국 FDA나 유럽의약품청(EMA: European Medicines Agency)의 키랄 약품 가이드라인이나 약품 개발 경향을 보면 다행히도 대부분은 단일 이성질체 약품개발이 대부분인 것으로 나타났다.
치료적 약물 모니터링(Therapeutic drug monitoring: TDM)
치료적 약물 모니터링(TDM)은 혈액 내 특정 약물의 양을 측정하여, 복용하는 약물의 양이 안전하고 효과적인지를 확인/검사하는 임상 약리학의 한 분야이다. 약물 중에는 치료의 효과를 실제로 나타낼수 있는 농도의 범위가 상당히 좁아서, 농도를 좀 약하게 투여하면 치료 효과가 미미해지거나 내성이 생기고 또 너무 많이 투여하면 독성을 보이거나 조직을 손상시킬 수 있는 약물들이 있다. 이렇게 치료 범위가 좁은 까다로운 약물들의 농도를 개인별로 최적화시키기 위하여 행하는 테스트가 TDM인 것이다. 일부 항암제나 항간질제, 면역억제제등이 여기에 포함된다. 개별 환자의 혈중 약물 농도를 모니터링하여 가장 최적의 약물농도를 파악하기 위해, 건강 상태의 변화, 함께 복용하는 다른 약물, 노화 등과 같은 요인들을 포함한 다양한 데이터들을 채집한다. 최근 TDM이 점점 더 관심을 받고 있는 배경에는 평균 수명은 점점 늘어났지만 안타깝게도 여러 종류의 약물을 동시에 복용하며 살아가는 현대인들이 상당히 늘어가고 있다는 현실이 있다. 물론 관련 의학 분야의 획기적인 기술 발달도 접근성이나 비용면에서 긍정적인 기여를 했다.
독성학(toxicology)의 원칙을 확립한 스위스의 의사 파라켈수스(Paracelsus)가 말했다. "모든 물질은 독이며, 독이 아닌 것은 없다. 문제는 용량에 있다(All things are poison, and nothing is without poison; only the dose makes a thing not a poison.)" 아무리 좋은 약도 지나치면 독이 될 수 있고, 모든 약은 그 자체로 독성을 내포하고 있다는 뜻이다. 약물이 작동하는 원리는 생체내 특정 경로를 조절하거나 방해하여 효과를 발휘하는 것이나 이 과정에서 의도되지 않은 주변 대상에 부정적인 영향을 끼칠 수도 있다. 약물이라는 화학물질을 대사하고 처리하려면 간은 더욱 열심히 일해야 하며 특히 체내에 축적될 경우 간독성을 초래할 수도 있다. 여러 개의 약물이 서로 부정적인 상승작용이나 간섭작용을 일으킬 수도 있다. 효과는 최대화하고 용량은 필요한 최소화만 지킬 수 있다면 가장 바람직할 것이다. 약물은 그 본질상 우리 몸에게 있어 결코 자연스러운 물질은 아닐 것이다.
키랄 약품이 두 가지 이성질체를 모두 갖는 라세미체로 합성된다는 점은 이러한 맥락에서 중요하다고 생각한다. 두 형태중 유도된 치료효과를 볼수 있는 활성이 몇 배 이상 더 강력한 이성질체만으로 약을 만든다면 그만큼 적은 투여량으로도 효과를 볼 수 있다. 유토머와 함께 흡수되는 불청객인 비활성 디스토머는 유토머의 치료 효과를 낭비할 수 있고, 치료 효과에 기여하지도 않으면서 오히려 약물 대사에 불필요하게 남아 부작용을 초래하거나 간이나 신장에 무리를 줄 수도 있다. 불필요한 디스토머는 약물이 표적 외에 엉뚱한 다른 생체 분자와 반응하여 의도하지 않은 생리적 반응이나 부작용을 일으킬 수도 있다(Off-target effect). 따라서 생물학적 표적이 더 선택적인 단일 이성질체의 사용은 부작용은 최소화하면서 안전하고 효과적인 치료를 가능하게 하는 약물 복용량 범위를 정해주는 TDM과 결을 같이한다고 볼 수 있다. 나는 매일 끼니때마다 약바구니에서 한 움큼의 약을 먹으면서 오래오래 살고 싶진 않다고 늘 말하지만, 그렇게 되지 않을 것이라고 장담한다면 그건 오만함일 것이다.
신약 제조의 추세
광학적으로 순수한 약물, 즉 라세미 혼합물이 아닌 단일 이성질체 약물이 1999년 이후 미국 식품의약국(FDA)가 승인한 전체 임상시험용 신약 허가 신청(INDs, Investigational New Drugs)의 절반 이상을 차지하고 있으며, 2010년 미국에서 판매된 상위 10개의 약물 중 8개가 키랄 약물이라는 보고가 있었다. [1] 이는 의약품 분야에서 거울상 이성질체가 차지하는 압도적인 비중과, 두 이성질체 중 단일 이성질체를 선택하여 약물을 개발함으로써 약효를 극대화하고 부작용을 최소화하는 방향으로 제약산업이 향하고 있음을 보여주는 수치라 할 수 있다.
실제로 1992년 미국 식품의약국(FDA)은 의약품 개발에서 입체화학적 특성을 고려해야 한다는 점을 강조하면서 키랄 화합물(stereoisomeric compounds) 개발과 관련된 규제 및 과학적 가이드라인을 제공하는 문서를 발표했다.[2] 이 문서를 통해 FDA는 두 이성질체가 모두 약리활성을 가지지만 효능, 특이성, 최대 효과면에서 큰 차이가 있을 경우 임상적으로 각각을 평가한 후, 더 적합한 하나의 이성질체만 개발하는 것이 중요하다고 명시하며 단일 이성질체 형태의 약물 개발을 권장하였다. 이 정책은 키랄 약물에 대하여 다소 엄격한 접근방법을 채택하여 키랄 약물에 대한 평가에 아주 자세한 지침을 제공하면서 단일한 거울상 이성질체 약물을 개발하는 것이 바람직하다고 명시 했다. 따라서 이 가이드라인은 키랄 약학 분야에 있어 중요한 전환점으로 여겨진다.
신규 약물 승인
FDA는 신규 약물과 관련하여, 이전에 승인하지않았던 활성 성분을 포함하는 약물들을 새로운 분자 개체(new molecular entity: NME)와 새로운 생물학적 개체(new biologic entities: NBE)로 분류하여 승인하였다. 한편 유럽의약청(European Medicines Agency: EMA)은 신규 약물과 관련하여 신규 활성 물질(new active substance: NAS)이라는 용어를 사용한다. NAS는 이전에 승인되지 않은 새로운 활성 성분을 포함하는 약물을 의미하며 기존에 유럽연합에서 승인된 적이 없는 화학 물질 또는 기존 화학 물질에서 변형된 형태(예: 이성질체, 유도체 등)가 포함된 약물로, 안전성 및 유효성 면에서 기존 물질과 차별화되는 특성을 보이는 경우가 이에 해당된다. [3] 단일이성질체가 기존 라세미체와 구별되는 약물학적 특성이 가지는 것으로 입증되면 NME나 NAS로 간주될 수 있다.
미국 FDA 신규 약물 승인 경향
신규 약물 승인에 단일 이성질체가 어떤 비중을 차지하는지 관련된 데이터를 찾아보았다. 수많은 자료를 취합하여 잘 정리한 보고서를 발견했다. [4] FDA의 자료와 이 보고서 논문의 데이터를 함께 살펴보았다. 먼저 아래는 2022년 기준 10년간의 FDA의 신규약물 승인 데이터를 보여준다. 대략 1년에 43개 정도의 신약이 승인되었다. 이 중에서 2020년에서 2022년의 3년 사이의 신약 승인만 따로 모아서 신약을 NME와 NBE 두 부류로 나누고 다시 생물학적 제제 NBE를 제외하고 NME만 다시 3가지로 세부 분류한 것을 그래프로 표현해 보았다. NME를 비키랄 소분자 약물, 단일 이성질체, 그리고 라세미 혼합물형태의 소분자로 나눈 맨 오른쪽 그래프를 보면 단일 거울상 이성질체 약물과 라세미혼합물 약물 간의 현격한 차이를 엿볼 수 있다.

3년간의 데이터를 보면, 키랄 약물이 비키랄 약물보다 더 많거나 거의 같다는 것을 알 수 있다. 또 키랄약물 중에서도 라세미화합물 형태의 약물은 거의 드물다. 2002년부터 2022년 간 NBE를 제외하고 따로 NME 소분자 분포만을 보여주는 아래 그래프에서도 키랄 약물이 비키랄 약물보다 훨씬 많은 것을 알 수 있다. 또한 단일 거울상 이성질체로 개발된 신약이 라세미체 신약보다 더 큰 비중을 차지하고 있는 것 또한 알 수 있다. 아래 그래프에 의하면 2013년부터 2022년까지 10년 동안 승인된 총 278개의 NME 소분자 중 라세미혼합물은 10개였다. 그 이전 2003년부터 2012년까지 10년 동안에는 전체 NME 소분자 211개 중 라세미체가 23개였으므로 대략 3배 정도 감소한 것이다. 비키랄 약물과 단일 거울상 이성질체 약물의 승인은 꾸준히 증가해 온 것으로 나타난다.

유럽 EMA 신규 약물 승인 경향
그렇다면 유럽의 신약 개발 경향은 어떠한가. 2013년부터 2022년까지 10년 동안 EMA가 승인한 신약인 신규 활성 물질(NAS) 데이터를 살펴보면, 처음 5년간 총 163건의 NAS를 다음 5년 동안은 206개의 신규 약물을 승인하였다. 유럽의 경우 생물학적 의약품이 훨씬 큰 비중으로 증가해 왔고 소분자 NAS신약 승인은 꾸준히 유지되는 추세로 보인다. 참고로, 위의 FDA 데이터의 경우 백신, 혈액, 체세포 조직등 생물학적 원료로부터 추출, 제조, 반합성된 생체 의약품은 통계에서 제외된 것이다. 이 글에서 관심을 가지고 보고 비교하고 싶은 영역은 소분자 신약 중 키랄과 비키랄, 그리고 단일 이성질체 약물과 라세미체 화합물 약물 간의 비교임을 강조하고 싶다. 각 해별로 소분자 NAS를 다시 3가지로 분류하여 비교한 것이 아래 오른쪽 그래프이다.
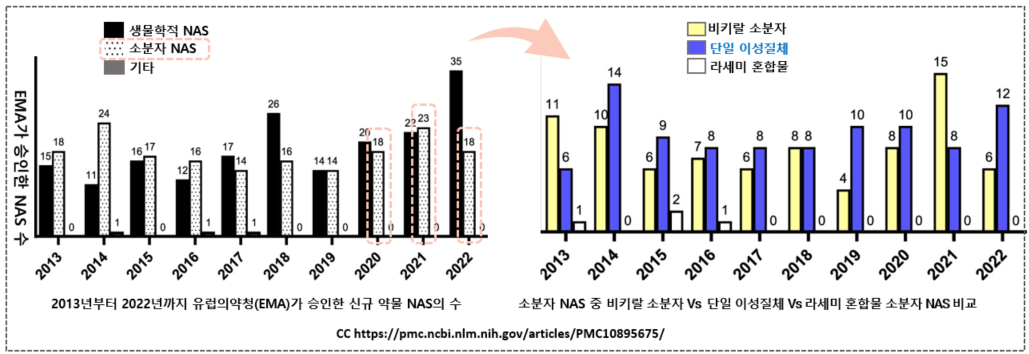
눈에 띄는 점은 2017년 이후 라세미체 혼합물로 승인된 약물이 없다는 점이다. 유럽에서도 비키랄 약물보다 키랄 약물이 더 비중을 차지하는 것으로 보인다. 위 자료들을 종합해 보면 결론적으로 미국과 유럽 모두에서 적어도 최근 20년 동안 키랄 약물의 비중은 커져왔으나, 라세미 혼합 형태의 약물은 매우 급속히 줄어들고 있고, 단일 이성질체형 약물의 수는 꾸준히 늘어가고 있음을 명백하게 볼 수 있었다.

현재 FDA와 EMA는 이미 등록되어 제조 판매 중인 라세미 혼합물 약물에서 활성성분을 분리하여 신약을 만드는 키랄 스위칭보다는 처음부터 순순한 거울상 이성질체 화합물 개발을 더 선호한다고 한다. 키랄 스위치 전략이 1994년과 2011년 사이에는 두드러졌으나 이후 10년 동안에는 덜 사용되었다고 한다. [5] 제약업체들의 이익이 아니라 환자들의 입장에서 치료효과의 최대화와 부작용 최소화가 목표가 되는 세상이 오고 있기를 바란다. 제약산업에 대해 늘 도끼눈을 뜨고 경계하는 나로서는, 1년에 신약이 채 50개도 승인되지 않고 있다는 사실에 솔직히 안도감이 들었다. 그만큼 긴 시간 동안 서두르지 않고 치밀하게 연구하고, 평가하고 검사하고 있다는 반증이 아닐까 싶어서이다.
국내 식약처와 신약 승인
한국의 경우, 2015년에 식품의약품안전처에서 안내서의 형태로 광학이성질체 의약품의 안전성, 유효성 평가에 대한 입장을 기술하였다. [6] 식약처 역시 “한쪽 이성질체가 독성 또는 원하지 않는 약리효과를 가지고 있고 다른 한쪽은 그렇지 않은 경우 단일 이성질체의 개발이 바람직하다.”는 가이드라인을 제시했다. 그리고 신약 개발과 관련하여 식약처의 보고서를 참고하면 대부분의 신약은 수입품목이고 국내 신약 개발은 매년 1~2 품목 정도였으나 2001년에는 한건도 없었다고 한다. 식약처 허가총괄담당관이 발표한 ‘2023년 의약품 허가보고서’에서 2012년부터 2023년까지 신약 허가 현황(분홍색 부분)을 참조하면 지난 10년 신약개발보다는 수입이 훨씬 더 비중을 차지함을 볼 수 있다. [7] 승인된 수입 신약의 자세한 내용까지 확인하지는 않았으나 미국과 유럽의 제약 경향과 비슷한 추세일 것으로 추정된다.

[참고 자료]
[1] A review of recent advances in mass spectrometric methods for gas-phase chiral analysis of pharmaceutical and biological compounds
https://doi.org/10.1016/j.jpba.2012.04.022
[2] Development of New Stereoisomeric Drugs
[3] New Active Substance categorisation and Orphan Similarity
[4] Chirality of New Drug Approvals (2013–2022): Trends and Perspectives
https://pmc.ncbi.nlm.nih.gov/articles/PMC10895675/
[5] Chiral Switch: Between Therapeutical Benefit and Marketing Strategy
https://doi.org/10.3390/ph15020240
[6] 광학이성질체 의약품 가이드라인[민원인 안내서] 2015.12, 2.2.1)
[7] 2023년 의약품 허가보고서 17쪽, 표 16-2. 연도별 신약의 화학·생물·첨단·한약(생약) 제제 허가 현황(’12년 ~ ’23년)
'세포생물학 > 생화학' 카테고리의 다른 글
| 키랄성 4: 키랄 약물의 두 얼굴(유토머 vs 디스토머) (0) | 2025.01.13 |
|---|---|
| 키랄성 3: 호모키랄성(homochirality):생명체의 선택 (3) | 2025.01.13 |
| 키랄성 2: 거울상 이성질체 명명법: d(+)/l(-), D/R, R/S (0) | 2025.01.13 |
| 키랄성 1: 거울에 비친 쌍둥이 이미지, 손의 속성, 키랄성(chirality) (1) | 2025.01.13 |
| 이소프렌, 테르펜, 이소프레노이드, 테르페노이드 그리고 콜레스테롤. (1) | 2024.10.25 |