기본적으로 탄소(C), 수소(H), 산소(O)의 3가지 원소로만 이루어진 단당류와 이당류를 넘어 올리고당과 다당류를 형성하는 단계로 넘어가면 당 구조가 변형된 다양한 기능성 당들이 등장한다. 단당류 구조의 일부분, 즉, 알데하이드기(-CHO)나 알코올기(-OH), 그리고 CH₂OH(하이드록시메틸기, hydroxymethyl group) 부위가 다른 원소로 치환되거나 산화되는 등 다양한 반응을 통하여 수정되고 변형되어 새로운 기능을 수행하는 단당류로 변신할 수 있다. 이러한 변형이 당이 생체내에서 하는 기능의 영역을 확장시키고 세포 구조와 신호전달 등에서 중요한 역할을 수행할 수 있게 해 준다. 이들의 구체적인 기능을 살펴보기 전에 먼저 다양한 변형당(modified sugar)들이 어떻게 생성되는지 그 과정을 자세히 알아보자.
I. 아미노당(amino sugar)
단백질을 이루는 아미노산의 핵심적인 기능 그룹인 아미노기(-NH₂)와 당이 만나 형성된 변형당이다. 단당류가 가진 많은 히드록시기(-OH) 중 하나를 NH₂로 치환한 것이다. 더 정확히 표현하면 단당류의 2번 탄소의 OH기를 NH₂기로 대체한 당이다. 60개 이상의 아미노당이 존재하지만, 우리는 대표적인 세 가지 아미노당이라 할 수 있는 글루코사민(glucosamine), 갈락토사민(galactosamine), 그리고 만노사민(mannosamine)에 집중하여 살펴보기로 한다. 명칭부터 보자면, 글루코스에 아미노기가 치환되어 생성된 하나의 독립적인 화합물이므로 glucose + amine으로 glucosamine이 된것이다. 따라서 갈락토스는 galactosamine, 만노스는 mannosamine이다. 매우 단순하고 친절한 이름이다.
추가적인 아세틸화 (-NHCOCH₃)
아미노기를 도입한 다음, 여기서 한발 더 나아가 아미노기(-NH₂)에 아세트산 (CH₃COOH)을 결합시킨다. 그 과정에서 물분자가 빠져나가고 아세틸기(-COCH₃)가 남아 아세틸화(-NHCOCH₃)된다. 이렇게 아세틸기를 추가하게 되면 구조적으로 보다 안정적인 성질을 갖게 되고, 친수성과 소수성간의 균형을 맞추어 분자의 극성을 조절할 수 있는 장점이 있다. 글루코스와 갈락토스가 이 두 과정을 거치게 되면 각각 N-아세틸 글루코사민(N-Acetylglucosamine, GlcNAc)과 N-아세틸 갈락토사민(N-Acetylgalactosamine, GalNAc)으로 변형되고 수정된다. 대표적로 글루코스(베타형)가 아세틸화되는 과정을 아래 도식으로 표현해 보았다.
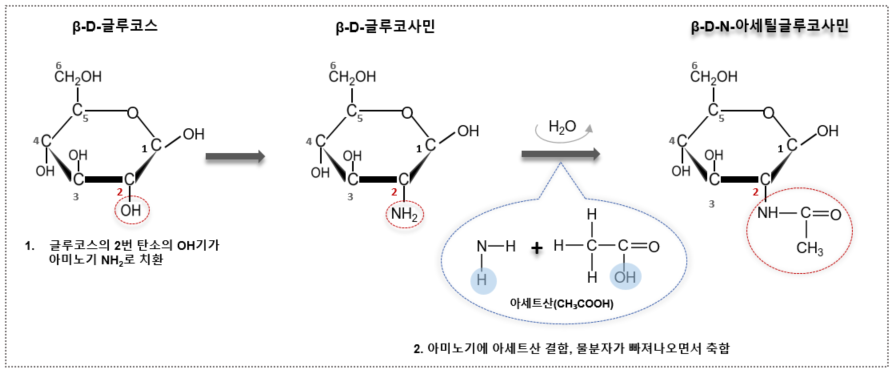
갈락토스와 만노스도 같은 방법으로 아세틸화되어 각각 N-아세틸 갈락토사민과 N-아세틸 만노사민이 된다. 앞선 글에서 보았듯이 글루코스와 갈락토스는 서로 단 한 군데의 키랄센터(4번 탄소)의 배열만 달라 서로 에피머(epimer)관계에 있고, 글루코스와 만노스 역시 2번 탄소에서 에피머관계에 있다. 그렇다고 해서 갈락토스와 만노스 역시 에피머관계인 것은 아니다. 이 둘은 2개의 위치에서 배열이 다르기 때문에 에피머 관계가 아니다.

이름이 길다 보니 축약형을 자주 쓴다. N-아세틸 글루코사민은 GlcNAc, N-아세틸 갈락토사민은 GalNAc , N-아세틸 만노사민은 ManNAc로 축약해서 많이 쓴다. 이들 약자는 기억해 놓으면 이후 당단백질 결합이나 GAG(글리코사미노글리칸) 합성에서 매우 유용하다.
글리코사미노글리칸(GAG, Glycosaminoglycan)의 주요 성분
글루코사민(β-D-Glucosamine, C₆H₁₃NO₅)은 인체 내에서 글루코스와 글루타민(Glutamine)을 재료로 자연스럽게 합성된다. 글루코사민과 같은 아미노당은 사실 아세틸화되어 안정된 상태에서 비로소 많은 중요한 기능을 발휘할 수 있게 된다고 할 수 있는데 예를 들어 GlcNAc는 연골의 건강과 밀접한 관계가 있다. 연골 조직은 그 기능적 특성상 세포외 기질(Extracellular Matrix)이 매우 풍부한데, 이 세포외 기질은 수분을 보유하고 충격을 흡수하는 프로테오글리칸(Proteoglycan), 구조적 지지를 담당하는 콜라겐(Collagen), 그리고 히알루론산, 콘드로이틴 황산과 같은 글리코사미노글리칸(GAG)등으로 구성되어 충격흡수와 체중지지와 같은 기능을 수행한다. 여기서 GAG를 주목해야 한다. 이들은 인체의 모든 세포외기질의 중요 구성성분으로 이당류들이 반복적으로 결합되어 있는 구조이다. 그 이당류의 한 단위가 바로 N-아세틸 글루코사민과(GlcNAc) N-아세틸 갈락토사민(GalNAc)과 같은 아미노당(aminosugar)이다. 아미노당 한 단위와 당산 한 단위가 합쳐진 이당류가 수많이 반복적으로 연결되어 히알루론산(hyaluronic acid), 콘드로이틴 황산(chondroitin sulfate), 케라탄 황산(keratan sulfate), 헤파린(heparin) 등의 GAG를 생합성하는 그 자세한 과정은 또 다른 변형당인 당산에 대하여 살펴본 후 이어지는 글에서 다루기로 한다.
키틴(chitin)
N-아세틸 글루코사민은 당산과 이당류 한 세트를 이루어 GAG의 주요 성분이 되기도 하지만 단독으로 곤충의 외골격(exoskeleton)이나 새우나 게와 같은 갑각류의 단단한 껍질, 또는 곰팡이를 비롯한 균류의 세포벽과 같은 다양한 생물 구조를 이루는 주요 성분이 되기도 하다. GlcNAc가 β(1→4) 결합으로 반복적으로 무수히 연결된 다당류가 키틴인데 키틴은 자연에서 셀룰로스 다음으로 가장 많이 발견되는 생체 고분자 다당류이다. 에너지 저장에는 주로 알파 결합이 나타나지만, 셀룰로스나 키틴과 같이 구조적 지지역할을 하는 경우에는 베타 결합을 이룬다. 달콤한 느낌을 먼저 연상시키는 당이 이렇게 딱딱하고 단단한 껍질이나 허물을 이루는 성분이 된다는 것은 참으로 흥미롭다.

키틴과 셀룰로스(Cellulose)의 유사점
키틴의 글리코시드 결합은 셀룰로스의 글리코시드 결합과 매우 유사하다. 셀룰로스가 β-아노머 형태의 글루코스들로 이루어져 있는 데 반해, 키틴은 β-아노머 형태의 N-아세틸글루코사민들로 이루어져 아세틸기를 가진 키틴이 더 단단하다는 점을 제외하곤 매우 유사하다. 둘 모두 β(1→4) 글리코시드 결합을 형성하는데, 이때 키틴과 셀룰로스 모두 1번과 4번의 OH기가 서로 방향이 다르기 때문에 자연스러운 결합을 위해 번갈아가면서 뒤집히면서(flip-flop) 연결된다. 이렇게 곁가지 없이 번갈아 가면서 뒤집혀 연결되면 곧은 직선형 사슬모양을 갖게 된다. 이렇게 기다란 선형 사슬의 위아래는 다시 수소결합으로 연결되어 식물의 세포벽이나 동물의 외피와 같은 튼튼하고 강도 높은 구조를 이루게 된다. 인체는 이러한 β-글리코시드 결합을 분해할 효소를 갖고 있지 않기 때문에 식이섬유를 소화시키지 못하는 것이다. 키틴이나 셀룰로스 모두 동일한 한 종류의 단당류가 모여 이루어진 동종다당류(homopolysaccharide)란 점도 같다.
II. 당산(sugar acid)
카르보닐기가 맨 바깥쪽에 위치한 알데하이드기를 가진 단당류를 알도스라고 한다. 글루코스나 갈락토스와 같은 알도스가 산화(oxidation)된 것이 당산이다. 이때 산화되는 위치가 1번 탄소의 알데하이드기인가 혹은 말단 6번 탄소의 하이드록시메틸기(-CH₂OH)인가에 따라 각각 알돈산(Aldonic acid)과 우론산(Uronic acid)이 된다. 1번과 6번 탄소가 동시에 산화되는 알다릭산(Aldaric acid)도 있는데 생체 내 필수적이고 특정한 대사적 기능이 잘 알려져 있지 않아 중요시되지 않는다. 알돈산 역시 생체 내 중간 대사산물로 등장할 수는 있으나 주요한 대사 경로에서 핵심적인 역할을 하지는 않는다고 한다. 따라서 실제로 당산과 관련하여 가장 주목받고 따라서 우리가 여기서 다룰 당산은 생체내에서 필수적이고 핵심적인 기능을 수행하는 우론산이다.
단당류의 6번 탄소가 산화되어 카르복실산(-COOH)으로 변한 당이 우론산이고, 어떤 단당류가 산화되었는가에 따라 글루쿠론산(Glucuronic acid, GlcA), 갈락투론산(Galacturonic acid, GalA), 만누론산(Mannuronic acid, ManA), 이두론산(Iduronic acid, IdoA)이 있다. 생체 기능에서 매우 중요한 역할을 하는 이들은 음식으로부터 직접 섭취되는 것이 아니라 생체내에서 대사과정을 통해 생성된다. 생체내에서 가장 중요한 두 가지 우론산은 먼저, 글루코스에서 변형된 글루쿠론산(GlcA)과 글루쿠론산과 5번 탄소 자리의 입체구조만 다른 에피머 관계에 있으며, 글루쿠론산과 달리 1번 탄소와 5번 탄소 사이의 회전이 자유로와 유연성이 특징인 이두론산(IdoA)이다.
간의 해독 과정: 1단계와 2단계
글루쿠론산(GlcA)이 인체 내에서 얼마나 중요한 역할을 하는지를 설명하려면 간의 해독과정을 살펴보면 된다. 간은 우리 몸에 들어와 역할을 마친 약물이나 해로운 물질, 독소등을 해독하는 기관이라고 한다. 얼뜻 들으면 이 ‘해독’이라는 말이 독을 무독한 것으로 바꾸거나 덜 해롭게 중화하는 것으로 오해할 수도 있는데, 간이 실제로 하는 해독 기능은 이 해로운 물질이 쉽게 몸 밖으로 배출될 수 있는 형태로 변형시켜 빨리 체내로 내보내 제거하는 것이다. 좀 더 구체적으로 말하자면, 약물이나 독성물질들은 대부분 극성을 띠지 않는 물을 싫어하는 소수성(hydrophobic) 물질들이어서 같은 성질의 지질 이중막으로 이루어진 세포막은 쉽게 통과하여 세포 안에서 축적될 수 있다. 인체가 원치 않는 물질을 체외로 배출하는 방법은 신장을 통한 소변이나 담즙을 통해 대변으로 배출시키는 두 가지 방법이 있는데 작은 분자량을 가진 친수성 물질은 신장에서 재흡수되지 않고 잘 여과되어 소변으로 배출되고, 분자량이 좀 더 큰 독성 물질은 담즙과 함께 대장으로 보내져 대변으로 배출된다. 결국 간의 해독이란 것은 독성물질들이 세포 내에 축적되지 않도록 소수성, 친유성, 비극성인 이들을 친수성, 수용성, 극성 물질로 변환시키는 것이고, 해독 과정이란 이러한 변환을 위한 여러 화학적 변형과정을 이르는데 CYP 450 계열 효소를 통해 산화, 환원, 가수분해의 방법을 동원하는 1단계(1상, Phase I)와 이 과정을 거쳤음에도 여전히 독성이 남아 있다면, 1단계를 거친 중간 독성물질에 한 단계 더 높은 수용성과 극성을 부여하기 위해 더 강력한 극성 분자를 추가시키는 2단계(2상, Phase II)로 나뉜다. 간 해독의 핵심목표는 빨리 밖으로 내보내 체내로부터 제거하는 것이기 때문이다. 2단계에는 아세틸기, 황(Sulfur), 글루타티온(Glutathione, GSH), 글루쿠론산 등을 추가하는 다양한 방법이 동원되는데 이 중에서 글루쿠론산을 추가하는 글루쿠론산 포합(Glucuronidation)이 2단계 반응 중 가장 중요하고 일반적인 방법이다.
글루쿠론산의 빌리루빈 배출
글루쿠론산(GlcA)은 체내에서 효과를 모두 발휘한 약물이나 독성 물질뿐 아니라 빌리루빈(Bilirubin) 배출에도 매우 중요하다. 적혈구가 수명을 다하면 폐기되는데 이때 철(Fe2+)과 글로빈 단백질은 재활용되지만 산소를 실어 나르는 핵심부위인 헴(heme)은 재활용되지 않고 배출되어야 한다. 이 수명을 다한 헴은 빌리루빈으로 분해된 후 간에서 글루쿠론산이 부착되어 극성이 강해지고 수용성 형태로 변환되면 담즙을 통해 배설된다. 빌리루벤이 이런 과정으로 배출되지 않으면 얼굴이 노랗게 되는 황달이 걸릴 수 있다. 참고로 빌리루빈이 담즙으로 배출되어 대장의 미생물에 의해 분해되면 우로빌리노겐(Urobilinogen)이 되는데, 이것이 다시 더 대사 되어 스테르코빌린(Stercobilin)과 우로빌린(Urobilin)을 형성하여 각각 대변과 소변이 갈색과 노란색을 띄게 만든다. 참고로 글루쿠론산이 처음 발견된 곳이 바로 소변이어서 소변을 나타내는 ‘urine’이 ‘-uronic’으로 이름에 포함된 것이라 한다.
글루쿠론산의 호르몬 배출
글루쿠론산은 호르몬 배출도 맡고 있다. 코르티솔, 에스트로겐, 테스테스테론과 같은 지용성 스테로이드 호르몬이나 갑상선 호르몬은 체내에서 일정시간만 작용하도록 되어 있고 시간이 지나면 효과도 감소할 뿐 아니라 체내에서 과다하게 축적되면 생리적으로 바람직하지 않은 작용을 일으켜 생리적 불균형을 유발할 수 있으므로 체내로 배출되어야 한다. 스트레스 상황에서 코르티솔이 증가하는 것은 정상적이지만 필요 이상으로 지속되면 면역 억제 등의 부작용이 생기므로 사용 후 빠르게 배출되어야 한다. 간에서 글루쿠론산이 이들과 포합 하여 수용성으로 변형시켜 소변이나 담즙을 통해 밖으로 배출시킨다.
생체내 글루쿠론산 합성 경로
글루코스가 전용 수용체(GLUT)를 이용해 인체 내 다양한 세포로 수송되어 들어온 순간, 다시 밖으로 빠져나가지 못하도록 음전하를 띄고 있는 인산(PO₄³⁻)을 붙여 세포 안에 가둬두는 작업을 한다. 이렇게 인산화(Phosphorylation를 시키는 이유는 전하를 가져 극성을 띄게 되면 GLUT를 통과할 수 없기 때문이다. 6번 탄소에 인산이 붙어 Glucose-6-Phosphate(G6P)라고 부른다. 글루코스 산화를 통한 모든 대사 작용의 공통적 출발점이다. 여기서 최종적으로 ATP를 생산하기 위해 쓰일 피브루산을 만드는 당 분해(Glycolysis) 경로로 진행될 수도 있고, 6번 탄소에 붙은 인산을 1번 자리로 옮겨(G1P) 글리코겐이나 글루쿠론산을 생성하는 경로로 진행될 수도 있다. 또한 인체 내 수많은 반응에 사용될 가장 효과적인 환원제이자 항산화에 중요한 역할을 하는 NADPH를 생산하거나 DNA나 RNA 등을 만들 리보스(오탄당)를 생산할 오탄당 인산 경로 (Pentose Phosphate Pathway, PPP)로 진행될 수도 있다. 저에너지 상태여서 에너지를 생산해야 할 상황인지, ATP가 충분히 있어 글리코겐으로 저장해야 할 상황인지, 활성산소(ROS)가 과다하여 항산화능력이 필요하거나 또는 핵산 합성이 필요한 상화인지, 해독 작용으로 몸 밖으로 배출해야 할 물질이 있는 상황 인가와 같이 세포의 상태와 필요에 따라 어떤 글루코스 대사 경로를 선택할지가 정교하게 선택되어 조절된다. G6P로부터 기인하는 중요한 대사 경로는 여기서 간단히 언급한 몇 가지 경로보다 훨씬 더 다양하다. 이 수많은 경로중 글루코스가 글루쿠론산으로 생합성되는 경로를 살펴보면서 우론산이 합성되는 과정을 들여다보자.

글루쿠론산은 음식을 통해 외부로부터 섭취하는 것이 아니라 생체내에서 합성되어야 하며, 체내에서 대부분 UDP-Glucuronic Acid의 형태로 존재하면서 해독작용이나 히알루론산이나 프로테오글리칸들을 합성하는 생화학적 과정에 참여한다. UDP(uridine diphosphate)와 같은 핵산이 붙어 반응성을 증가시켜 주고, 효소가 쉽게 식별하여 효소반응이 원활하게 이루어지게 도와준다. 위의 도식에서 나타난 과정을 통해 UDP-글루쿠론산이 합성된 후, 다시 여러 대사경로에서 사용되는데, 비록 안타깝게도 효소가 없어 인체에서는 일어나지는 않지만 비타민 C(아스코르브산, Ascorbic Acid)의 생합성도 그중 하나이다.
아미노당과 당산을 짚어보았다. 이 재료들이 반반씩 합쳐져 이당류를 형성하고, 그 이당류가 무수히 반복적으로 연결되어 형성된 다당류인 GAG를 본격적으로 탐구해 볼 수 있는 준비가 되었다. 피부, 관절, 망막, 혈관 등 여러 조직의 세포외기질에서 수분을 보유하여 조직의 탄력성과 충격흡수력을 높여주고, 세포 간의 신호전달과 상호 작용, 항응고 작용을 비롯하여 면역조절과 같은 중요한 생리적 기능을 수행하는 너무나 중요한 다당류인 GAG에 대한 고찰을 다음 글에서 이어가 보자.
'당(sugar) 관련 > 탄수화물' 카테고리의 다른 글
| 탄수화물 9: GAG: 헤파린과 헤파란 황산 (0) | 2025.04.06 |
|---|---|
| 탄수화물 8: 글리코사미노글리칸(GAG): 히알루론산, 콘드로이틴 황산, 더르마탄 황산, 케라탄 황산 (0) | 2025.04.06 |
| 탄수화물 6: 올리고당(feat 단쇄지방산과 단백질번역후 변형) (0) | 2025.04.06 |
| 탄수화물 5: 이당류를 형성하는 글리코시드 결합(feat 말토스, 락토스, 수크로스 (0) | 2025.04.06 |
| 탄수화물 4: 헤미아세탈 Vs 헤미케탈(feat 과당의 고리화) (0) | 2025.04.06 |