앞 글에서, 가수분해가 더 이상 되지 않는 가장 간단한 형태의 단당류와 그 입체 이성질체를 살펴보았고, 이어서 다양한 단당류 2 단위가 글리코사이드 결합으로 묶여서 형성되는 대표적 이당류 3가지를 자세히 고찰해 보았다. 2개 이상이면 모두 다당류라고 할 수 있겠지만, 다당류는 수십에서 수천 개 많게는 10,000개나 되는 단당류들이 연결되어 형성되기도 한다. 따라서 이당류와 다당류 중간쯤에 대략 단당류 3개에서 10개 정도가 모여 형성된 다당류를 올리고당 또는 소당류라고 한다. ‘Oligo’는 ‘소수(few)’, ‘약간(little)’이라는 뜻이라고 한다. 이당류도 올리고당에 포함시키기도 하지만, 우리는 이미 이당류를 따로 다루었으므로 제외하고 이 글에서는 그 외의 올리고당을 살펴보자.
올리고당은 먼저 크게 두 가지 즉, 자연에서 발생하여 인체가 섭취하는 올리고당과 인체 내에서 자체적으로 합성되는 올리고당으로 분류할 수 있다.
1. 식이성 올리고당(dietary oligosaccharides)
주로 식물과 유제품에서 발견되는 올리고당들은 다양한 식품을 통해 섭취된다. 주로 과당으로 이루어진 프락토올리고당(FOS, Fructo-oligosaccharide)은 양파, 마늘, 바나나와 같은 식물에서, 주로 갈락토스로 이루어진 갈락토올리고당(GOS, Galacto-oligosaccharide)은 모유나 유제품에 풍부하게 존재한다. 글루코스 단위로 이루어진 말토올리고당(MOS, Malto-oligosaccharides)은 녹말 분해 과정에서 생성되는데 글루코스 두 단위로 이루어진 말토스보다 더 긴 형태이다. 프락토올리고당보다 과당이 더 많이 길게 연결된 이눌린(Inulin)은 치커리, 아스파라거스 등에서 많이 발견된다.
프락토올리고당(FOS), 갈락토올리고당(GOS), 이눌린, 말토올리고당(MOS)의 가장 주요한 기능은 발효라는 과정을 통해 장 내 미생물들의 먹이 즉, 프리바이오틱스(prebiotics)가 된다는 것이다. 이를 이해하기 위해 대장에서 일어나는 발효에 대해 먼저 살펴보자. 인체는 해당과정(Glycolysis)을 통해 당을 분해하여 사용 가능한 에너지를 만들어 낸다. 당이 분해되면 이를 받아 미토콘드리아 전자 전달계가 작동하여 ATP를 생산하는데 이 과정에 산소가 꼭 필요하다. ATP 생산 과정에서 산소가 전자수용체 역할을 하기 때문인데, 산소가 없는 환경에서 에너지를 만들어 내려면 산소 대신 피부르산(Pyruvic acid)과 같은 다른 유기물이 전자수용체로 역할을 해줘야 한다. 대장은 산소가 없는 환경이고, 대장 내에는 산소가 없어야 생존할 수 있는 혐기성 미생물이 90% 이상 차지하고 있으므로 이들은 소장에서 소화 흡수되지 않고 대장까지 넘어온 식이섬유나 올리고당을 분해하여 ATP를 얻는데, 이 과정에서 대사의 부산물로 단쇄 지방산, 알코올, 가스(H₂, CO₂, CH₄ 등)가 생성된다. 이렇게 혐기 환경인 대장에서 에너지를 얻어내는 이 생화학적 과정이 바로 발효라고 할 수 있다. 즉, 산, 알코올, 가스는 발효의 부산물이다. 알코올은 매우 미량으로 생성되고, 가스는 방귀나 트림, 때로는 복부팽만을 일으키기도 한다. 우리가 관심을 가져야 할 것은 바로 미생물들이 발효를 통해 만들어낸 단쇄지방산(SCFAs, Short-Chain Fatty Acids)이다.
장내 미생물의 발효로 아세트산(Acetate), 프로피온산(Propionate), 부티르산(Butyrate)과 같은 단쇄 지방산이 풍부해지면 장내 환경이 약산성(pH 5~6)으로 유지된다. 장내 미생물들 군집에는 유익균과 유해균이 공존하고 있으며 어느 균이 더 우세한가 가 우리 인체의 건강과 직결된다는 점을 고려할 때, 산성환경이 유지된다는 것은 대장균과 같은 유해균의 성장이 억제되고 산성에서도 잘 생존하는 비피더스나 락토바실러스와 같은 유익균이 더 증식한다는 것을 의미한다. 한정된 공간을 놓고 두 균간의 자리싸움에서 유익균이 더 많이 정착하게 되어 장내 세균의 균형이 유익균 쪽으로 기울게 되는 것이다. 부티르산(Butyrate)은 대장 상피세포의 주요 에너지원으로 사용되고, 뮤신(mucin)과 같은 점액을 분비하여 장의 점막과 장벽을 보호하고 재생을 촉진시켜 장누수증후군(Leaky Gut)을 예방하는 데에도 매우 중요하다. 프로피온산(Propionate)은 간에서 글루코스가 새로 합성되는 것 즉, 글루코스 신생합성(gluconeogenesis)을 조절하는 중요한 대사 중간체로서 혈당 상승을 억제하고 인슐린 감수성을 증가시켜 당뇨병을 예방할 수 있는 중요한 역할을 한다. 단쇄지방산은 면역기능향상에도 도움을 준다.
단쇄지방산과 T세포(Treg)의 만남
단쇄지방산과 면역기능향상 간의 관계를 살펴보기 위해 먼저, 면역 체계에서 중요한 역할을 하는 T세포를 알아보자. T세포들은 흉선에서 교육받은 후 두 차례의 까다로운 선별 과정을 통과한 소수의 ‘엘리트’ 세포들이다. 하지만 이들이 혹독한 교육과정에서 살아남기는 했지만 곧바로 완전한 전투력을 갖게 되는 것은 아니고, 아직 항원을 직접 만나 본 적이 없는 기능적으로 미성숙한 상태이기 때문에 CD4⁺ T 세포 또는 CD8⁺ T 세포 상태로 2차 림프기관(림프절, 비장 등)에서 대기한다. 그래서 이들을 글자 그대로 나쁜 적을 만나본 경험이 전혀 없는 ‘미성숙 CD4⁺, CD8⁺ T 세포(naïve T cell)’라고 부른다. 이들은 림프절에서 대기하다가 돌아다니다 항원을 만나면 잡아서 알려주는 항원 제시 세포(APC, Antigen-Presenting Cell)들에 의해 항원을 인식하면 비로소 활성화되고 이후, 주변 환경의 다양한 사이토카인에 반응하고 그 사이토카인들의 신호에 따라 Th1, Th2, Th17, Treg 등의 다양한 T세포로 분화하며, 이 분화된 T 세포들은 각기 특징적인 사이토카인들을 분비하며 특화된 면역 반응을 수행하게 된다. 이 중에서 Treg (regulatory T cell, 조절 T 세포)는 면역 반응의 ‘브레이크’ 역할을 하며, 과도한 면역 활성화를 막아 균형을 유지하는 중요한 기능을 하는 자가면역 질환과 염증성 질환을 억제하는 데 필수적인 T 세포이다.
바로 이 중요한 조절 T세포 (Treg)의 분화를 장내 유익균들이 돕는다는 사실이 알려진 것이다. FOXP3(Forkhead box P3)라는 전사인자는 Treg 세포 발달과 기능을 조절하는 핵심 전사인데 부티르산이 이 인자의 히스톤 탈아세틸화 억제제(HDAC inhibitor)로 작용하여 FOXP3의 유전자 발현을 직접적으로 증가시켜 Treg 분화를 촉진시키게 된다. 또한 미생물들이 생성시킨 단쇄지방산들이 장 상피세포와 항원제시세포들을 자극하여 TGF-β(변환 성장 인자 β, transforming growth factor β)라는 사이토카인의 분비를 증가시키게 되면, 이 증가된 TGF-β 사이토카인이 미성숙 CD4⁺ T 세포에서 FOX3인자의 발현을 촉진하게 되어 Treg의 분화를 유도하게 된다. 결국, 단쇄지방산은 FOXP3 발현을 직접적으로 증가시키기도 하고, TGF-β 생성을 촉진하여 간접적으로도 FOXP3 발현을 높이는 이중 역할을 하며 이를 통해 생성된 Treg 세포는 강력한 항염증성 사이토카인인 IL-10과 함께 과도한 면역 반응을 억제하고, 면역 항상성을 유지하는 역할을 한다.
Treg가 증가되면 많은 면역질환에 좋은 영향을 끼칠 수 있는데, 염증성 장질환 (Inflammatory bowel disease), 크론병, 궤양성 대장염 등을 예방하거나, 알레르기나 천식과 같은 과민성 면역 반응을 완화시킬 수도 있고, 1형 당뇨나 류마티스 관절염과 같은 자가면역 질환(Autoimmune disease)의 위험도 감소시킬 수 있다는 것이다. 장내미생물과 면역과의 관계가 물론 여전히 연구 중이기는 하지만, 건강한 장 내 환경을 유지하는 것이 분명 면역균형을 유지하는데 도움을 준다는 것은 명백하다고 생각한다. 오랜 기간 동안 장내 미생물 덕후로 살아온 일인인 나는 이 부분에 대한 좀 더 자세하고 체계적인 내용을 다른 글에서 다시 다루고자 한다.

2. 인체에서 합성하는 올리고당
자연에서 발견되는 올리고당이 주로 식물에서 발견되는데 반해, 인체에서 합성되는 올리고당은 독립적으로 존재하기보다는 단백질이나 지질과 같은 다른 생체분자에 결합하여 존재한다. 단당류가 대략 2개 ~ 10개 정도가 글리코시드 결합된것을 올리고당이라고 부른다면 여기서 우리는 글리칸(glycan)이라는 개념도 함께 이해해 두는 것이 좋겠다. 당생물학에서는 글리칸을 당이 여러개 연결된 사슬, 올리고당, 다당류 심지어 탄수화물과 비슷하거나 같은 의미로 매우 광범위하게 사용한다. 단당류가 여러개 글리코시드 결합으로 연결되있다는 측면에서 특히 올리고당과 매우 겹치는 개념인데 편의상 이해를 보다 쉽게 하기 위해 경계를 좀 그려보자면, 글리칸이라는 개념하에 올리고당과 다당류가 포함된다고 볼 수 있다. 그리고 글리칸이 각각 단백질과 지질과 결합한 형태인 당단백질(Glycoprotein)과 당지질(Glycolipid)을 당접합체(glycoconjugate) 라고 하고, 당단백질 중에서 그 구성중 글리칸이 훨씬 더 큰 비중을 차지하는 것을 특히 프로테오글리칸(proteoglycan)이라고 한다고 정리한다. 단백질이 합성된후 거친 소포체(ER)과 골지체를 통과하면서 이들의 특정 아미노산 잔기에 다양한 단당류로 이루언진 당사슬이 효소의 작용에 의해 부착되는 것을 단백질의 당화(glycosylation)라고 하는데, 이 때 부착되는 짧은 당사슬을 일반적으로 올리고당이라고 부르기도 하고, 글리칸이라고도 부른다는 것을 이해하자. 명칭에 대한 정리가 조금 되었으면, 세포내에서 단백질 합성과정에서 올리고당을 부착하는 의미와 그 중요성에 대하여 알아보자.
먼저 단백질을 생성하는데 재료인 유전자 수가 생각보다 많지 않다는 점을 지적하고 싶다. 생식세포를 제외한 인체의 모든 세포에는 완전한 유전체(Genome), 즉 풀세트의 유전 정보가 핵 속에 포함되어 있는데, 2000년대 초 인간 게놈 프로젝트의 결과로 우리는 인체가 단백질을 합성할 수 있는 유전자가 대략 20,000 ~ 25,000여 개에 불과하다는 것을 알게 되었다. 생각보다 너무나 작은 수여서 우리 모두가 놀랐다. 심지어 초파리의 유전자수도 약 15,000개라고 하니 더 놀라울 수밖에 없다. 하지만 다행히도 우리 인체는 이렇게 작은 유전자 수를 가지고도 그 수보다 훨씬 많고 다양한 종류의 단백질을 생성할 수 있는 여러 가지 방책을 갖고 있다. 먼저 대체적 스플라이싱(Alternative Splicing)을 통해 하나의 유전자로도 다양하게 조합하여 서로 다른 여러 개의 단백질을 만들 수도 있고, 단백질의 번역 후 변형 (Post-Translational Modifications, PTMs)을 통해 유전자를 번역하여 단백질을 만든 이후 여기에 다양한 화학적 변형을 가하여 기능을 달라지게 만들 수도 있다. 여러 단백질을 결합시켜 단백질 복합체(Protein Complex Assembly)를 형성하여 새로운 역할을 수행하게 할 수도 있다. 이렇게 다양한 방법을 통해 유전자수보다 훨씬 많은 100만 개 이상의 다양한 단백질을 생성하여 인체의 복잡한 생명활동을 유지할 수 있다고 한다. 이러한 인체의 똑똑한 생물학적 전략 중 하나가 바로 단백질의 당화로서 단백질 번역 후 변형 중 가장 대표적이고 복잡한 방법 중 하나라고 한다.
| 유전자 대체 스플라이싱(alternative RNA splicing: 대체 접합) 단백질 합성과정의 첫 단계는 핵에서 DNA의 암호화된 유전자 정보를 전사(transcription: 복사)하는 것이다(pre-mRNA). 이 복사본을 실제로 단백질 합성(translation, 번역)에 사용될 mRNA로 사용하려면 먼저 사전 다듬기 작업이 필요하다. 왜냐하면, 초벌로 복사해온 것 중에는 단백질 생성 코드 정보가 포함되어있는 exon과 함께 유전자 정보가 없는 intron부위도 중간중간 끼어서 섞여 있기 때문에 정리가 필요한 것이다. Intron 부위는 제거해야 하고 exon들만 이어 붙어야한다. exon들을 선택적으로 조합하여 편집할 수 있는데, 이 때 어떤 방식으로 편집하느냐에 따라 하나의 유전자로부터 다수의 다양한 유전자 복사가 가능해지는데 이러한 과정을 대체 접합이라고 한다. 즉, 원본은 같으나 복사하는 과정에서 약간의 차이가 생기면서 결과물이 달라지는 것으로, 이 과정을 통해 단백질의 상당한 다양성을 확보할수있다. 유전자의 무려 95%가 대체 스플라이싱을 겪는다고한다.[1] |
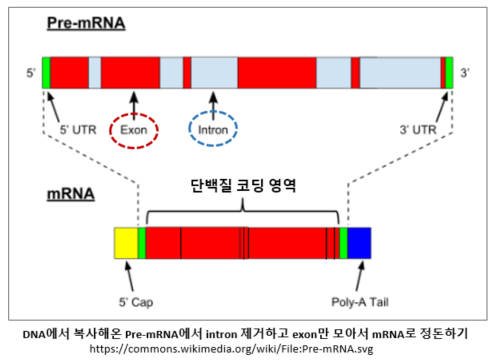
단백질 합성 과정과 올리고당
외부로부터 신호를 받거나 혹은 세포 내 필요에 의해 세포가 단백질을 합성하는 과정을 아주 간단히 살펴보면, 먼저 핵(Nucleus) 안의 DNA에서 특정 유전자의 정보를 RNA(mRNA)로 복사한다. mRNA는 핵에서 나와 세포질로 이동하여 리보솜에서 그 유전자 정보를 해석하고 번역(Translation)한다. 리보솜은 단백질 제조 공장으로서 세포질에 둥둥 자유롭게 떠다니기도 하고 핵과 연결된 소포체에 다닥다닥 붙어 있기도 하다. 그렇게 점처럼 무수히 붙어있는 리보솜 때문에 거친 소포체(rough ER)란 이름이 붙은 것이다. 반대로 리보솜이 안 붙은 부드러운 소포체(smooth ER)도 있다. 리보솜은 그 수가 수천에서 수백만까지 무수히 많을 수 있는데 세포가 활발한 대사를 할수록 그 수가 더 많아진다. 리보솜 안에서 tRNA가 단백질을 만들 재료인 아미노산을 운반하며, 이를 연결하여 폴리펩타이드를 형성하면 단백질의 기본 구조가 만들어진다. 이렇게 만들어진 폴리펩타이드는 소포체를 통과해 지나가면서 단백질이 안정적으로 기능하기 위해 폴딩(Folding)과 초기 가공을 거치는데, 이 단계에서 N-글리코실화(N-Glycosylation)를 통해 올리고당이 첨가되어 단백질을 수정하고 단백질의 안정성과 기능을 조율하고 태그를 붙여 단백질이 어디로 가야 할지를 표시한다. 이후, 단백질은 골지체(Golgi apparatus)로 이동하여 필요하면 추가적인 가공 및 수정을 거친 뒤, 최종 목적지로 이동한다. 이렇게 완성된 단백질은 세포막에 부착되어 채널단백질, 수송단백질과 같은 막단백질이 되거나, 호르몬이나 NT, 항체처럼 세포 밖으로 분비되거나, 혹은 라이소좀(lysosome)과 세포 내 같은 소기관에서 기능을 수행하게 된다.
세포막에 부착되어 있는 당단백질도 있고, 세포막에 붙어있지 않고 세포 밖이나 세포외기질로 분비되어 나가는 당단백질도 있다. 우리에게 친숙한 몇 가지를 나열해 보자면, 세포가 신호를 받아들이는 창구인 세포막 수용체, 혈액형을 결정하게 해주는 항원단백질들은 세포막에 붙어 있고, 항체나 호르몬과 같은 당단백질은 분비되어 혈액이나 세포외기질에서 존재한다.
단백질의 당화(glycosylation)
올리고당(또는 글리칸)을 단백질에 결합하는 방법을 좀 더 자세히 살펴보자. 대표적인 2가지 방법으로 N-결합 당화(N- linked glycosylation)와 O-결합 당화 (O-linked Glycosylation)가 있다. 여기서 O와 N이 의미하는 바는 매우 단순한데 결합이 이루어지는 바로 그 접점의 원자를 가리키기 때문이다. 아미노산중에서 당과 결합될 수 있는 것은 3가지뿐이다. 아스파라긴(Asparagine, Asn), 세린(Serine, Ser), 트레오닌(Threonine, Thr)이 그것인데, 아스파라긴의 질소(N)에 당이 결합하는 것이 N-결합 당화이고, 세린과 트레오닌의 OH기의 산소(O)에 당이 결합하는 것이 O-결합 당화이다. 참고로, N-결합 당화로 부착되는 올리고당을 N-글리칸이라고 부르고, O-결합 당화로 부착되는 것은 O-글리칸으로 부른다는 것을 기억해두면 도움이 된다. 이제 올리고당으로 부르던 글리칸이라고 부르던 어떤 당사슬이 단백질과 지질의 확장에 참여하는지 궁금해진다.
변형 또는 수정된 당(Modified Sugars)
ER이나 골지체에서 단백질에 올리고당을 부착하기 전 먼저 여기에 붙일 올리고당을 조합하게 되는데, 이 과정에는 우리가 지금까지 다루었던 수많은 단당류 들와 더불어 새로운 형태의 단당류들이 등장한다. 사실 그 수많은 단당류와 이당류들 그리고 일부 올리고당들이 탄소, 수소, 산소 딱 3가지 원소만으로 이루어져 있다는 것도 엄청 놀랍다고 생각한다. 이제 여기에 더해 더 많은 원소들이 첨가되게 된다. 우리가 잘 아는 글루코스나 과당과 같은 단순한 단당류들이 약간의 화학적 과정을 거치면서 수정되고 변형되어 생긴 당을 변형당(modified sugars)또는 유도당(derivative sugars)이라고 하는데, 이 변형당의 종류에는 내부의 OH기 하나를 아미노기(NH2)로 대체한 아미노당, 알데하드기나 케톤기 대신 OH기가 결합한 당알코올, OH기에서 산소를 제거해 버린 디옥시당, 카르복실기(COOH)를 가지는 산성당, 황산기(-SO₃⁻)가 붙은 황산당 등이 있다.
이들 변형당은 올리고당 형성에서 등장할 뿐 아니라 다당류를 형성에도 참여하여 세포벽이나 외골격을 만들고 면역조절, 신호전달등에서 중요한 기능을 수행한다. 사실, 고백하건대, 21세기 최대의 화두 중 하나인 탄수화물을 제대로 학습해 보겠다고 다짐하고 이 들 변형당과 마주할 즈음이면 영락없이 내 뇌는 서서히 갈 곳을 잃고 눈의 초점은 흐려지면서 점점 헤매기 시작하다가 흥미를 잃기가 일쑤였다. 이름도 어찌나 길고 복잡한지 한마디로 정신줄 놓기 딱 좋은 지점이었다. 하지만, 변형당은 당접합체 형성에서 항상 첫 출발점부터 등장하기 때문에 반드시 이해해야 하므로 이참에 각 잡고 제대로 정리해보고자 한다. 항상 느끼는 것이지만, 이름이 길다는 것은 그만큼 이름 안에 많은 설명이 있다는 것이므로 선입견을 버리기로 했다.
사실 변형당들은 우리에게도 나름 꽤 친숙한 존재들인데, 연골을 재생해 관절염(Arthritis) 치료에 효과적이라는 글루코사민, 수분을 촉촉이 잡아당겨 피부보습에 뛰어나 화장품 광고에 자주 나오는 ‘히알루론산’, 칼로리가 없어 다이어트 시 많이 이용하는 에리스트리톨(Erythritol)과 같은 대체 감미료, 이 들 모두가 변형당을 포함한다. ‘당’이라는 이름에서 연상되는 단맛을 넘어, 훨씬 복잡하고 다양한 생체내 생물학적 기능을 수행하기 위해 ‘당’으로서의 정체성은 접고 새롭게 변모한다고 할 수 있다. 우리의 혈액형을 결정하는 것도 이들 변형당이다. 바이러스가 인체 숙주세포로 침입하는 지점과 직접적으로 관련되는 것도 변형당이다.
단당류를 변형시켜 생성된 변형당을 이어지는 다음 글에서 주로 글루코스를 비롯한 일부 대표적 단당류를 중심으로 상세히 다뤄보도록 하자.
[참고 자료]
[1] How many human proteoforms are there?
doi: 10.1038/nchembio.2576
'당(sugar) 관련 > 탄수화물' 카테고리의 다른 글
| 탄수화물 8: 글리코사미노글리칸(GAG): 히알루론산, 콘드로이틴 황산, 더르마탄 황산, 케라탄 황산 (0) | 2025.04.06 |
|---|---|
| 탄수화물 7: 아미노당(amino sugar)과 당산(sugar acid) (0) | 2025.04.06 |
| 탄수화물 5: 이당류를 형성하는 글리코시드 결합(feat 말토스, 락토스, 수크로스 (0) | 2025.04.06 |
| 탄수화물 4: 헤미아세탈 Vs 헤미케탈(feat 과당의 고리화) (0) | 2025.04.06 |
| 탄수화물 3: 단당류의 고리화과정(피라노스 Vs 푸라노스) (0) | 2025.04.06 |