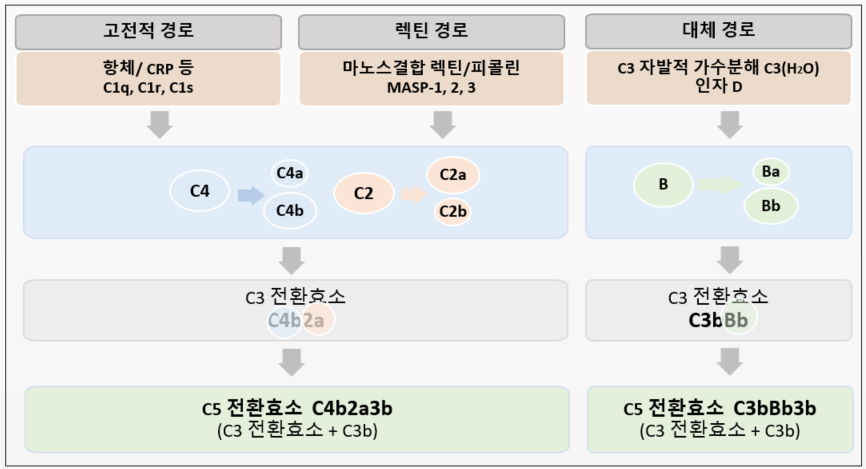
C3 전환효소(C3 Convertase)를 만들기까지의 3가지 cascade 경로
1. 고전적 경로(classical pathway) : 선천 면역 & 적응 면역
고전적 경로는 주로 2개 이상의 항원-항체 복합체(=면역복합체)에 보체 C1 복합체가 결합하면서 시작된다. 이 경우, 항체와 결합하기 때문에 적응면역에 해당한다고 할 수 있다. 5가지 항체(Ig: Immunoglobulin) 계열 중 IgM 계열의 항체와 IgG 계열의 항체만이 보체와 결합하여 보체를 활성화할 수 있다. 물론 이 경로는 항체와 상관없이 일부 병원체의 표면에 직접 결합하면서 시작할 수 있기 때문에 이 경우는 선천 면역에 기여한 다고 할 수 있다. 급성 염증이나 감염이 발생한 경우 이에 대한 급성 반응으로 생성되는 C 반응성 단백질(CRP), 아밀로이드 베타 펩타이드(amyloid-beta peptides: 아밀로이드 플라크를 형성하여 알츠하이머병을 유발할 수도 있음), 손상된 조직의 일부, 노화된 세포, 세포사멸 중이거나 제대로 사멸되지 않은 세포의 일부분(DNA, RNA 등) 등과 같은 성분들을 인식하고 이들과 결합하여 보체가 활성화되기도 한다는 뜻이다. 이러한 성분을 손상 패턴인식요소(pattern recognition)이라고 한다. 특히 병원체가 아닌 제거되어야 할 숙주 세포나 조직들을 인식하여 시기적절하게 제거하고 청소하는 것은 자가면역과 같은 질병과도 연관이 있으므로 매우 중요하다. 하지만 일반적으로 고전적 경로는 항체와의 결합으로 개시되는 것을 지칭한다.
| CRP(C-reactive protein): 대식세포나 T 세포와 같은 면역세포가 분비하는 IL-6 등의 사이토카인에 대한 반응으로 간에서 합성된다. CRP는 죽거나 죽어가는 박테리아나 미생물의 세포막 구성성분인 포스포콜린에 결합하여 보체의 C1q에 결합한다. 임상적으로는 바이러스 감염이나 염증이 있을 경우 혈액내 CRP 양이 급속도로 증가하기 때문에 그 수치를 측정하여 염증 여부를 테스트하는데 활용된다. |
C1 복합체 활성화
보체의 첫번째 구성성분인 C1을 현미경으로 보면 튤립 한 다발을 거꾸로 해놓은 것 같기도 하고 개구리 왕발가락 같기도 하다. C1은 C1q, C1r, C1s로 구성된 복합체이고 C1r, C1s은 세린 프로테아제(serine protease, 단백질분해효소)이다. C1q(아래 그림에서 핑크색)은 콜라겐 유사 도메인을 가진 막대 부분과 아래 렉틴 유사 부분을 가진 둥그런 머리 부분으로 이루어져 있는 일종의 콜렉틴(콜라겐 + 렉틴) 단백질이다. C1q의 머리 부분이 2개 이상의 항체(Fc부위)에 결합하거나 또는 병원체에 직접 결합하면 C1r에 구조적인 변화가 생기면서 자체적으로 효소가 활성화된다. 활성화된 C1r은 곧이어 C1s를 분절시켜 활성화시킨다. 지모겐(비활성 효소전구체 상태: zimogen)였던 C1s효소가 깨어나 활성화된 것이다.

| 에피토프(epitope) : 항체나 T세포들의 수용체와 결합하는 항원의 특정 부위를 말한다. 두 조각의 퍼즐이 맞아떨어지듯 항체의 수용체와 에피토프가 맞아떨어져야 항체가 작동한다. 하나의 항원이 여러 개의 다른 에피토프 부위를 가질수도 있으므로 하나의 항원에 각 에피토프에 특이적인 항체가 여럿 결합할수도 있다. 항원결정 부위(antigenic determinant)라고도 부른다. 참고로 항원과 직접 상호작용하는 항체의 특정 부위는 파라토프(paratope)라고 한다. |
C4, C2 활성화
이제 C1s는 보체 분자 C4와 C2를 각각 C4a, C4b와 C2a, C2b로 차례대로 분절시킨다. 한 분자의 C1s는 다수의 C4와 C2를 분절시킬수 있음을 기억하자. 여기서 만들어진 C2a와 C4b가 합쳐진 복합체가 바로 C3 전환효소가 될 것이다. 순서대로 살펴보자. 먼저 C1s가 C4를 절단하는데, 잘려 나간 작은 조각 C4a는 국소적 염증반응을 시작하지만 그 효과는 매우 미미하다. C4가 분절되면 이때 C4b의 내부의 thioester결합 부위가 노출되어 그 부분이 병원체 표면과 공유 결합하는 반응이 일어나 병원체에 달라붙게 된다. 병원체 표면에 달라붙은 C4b에 C2가 와서 결합한다. 이렇게 결합한 상태가 되면 C1s가 C2를 분절시켜 활성화시키기가 더 용이해진다. C2는 C2a와 C2b로 분절시킨다(앞 글에서 보았듯이 예외적으로 더 큰 조각에 “a”가 붙었다). 작은 조각 C2b는 잘려 떨어져 나가고, 세포벽에 붙은 채 결합되어 남아 있는 C2a와 C4b는 복합체로서 C3전환효소라는 이름으로 C3를 분절하는 효소단백질이 된다. C3 전환효소가 탄생했다. 이 C3 전환효소 복합체에서 C2a단편이 활성화된 세린 프로테아제 부분으로서 실질적으로 C3 분자를 분절하는 주체이다. C3 전환효소보다 C3 분절효소라고 했으면 더 의미가 선명하지 않았을까 싶다.(난 늘 명명법에 불만이 많은 하수이다 ㅎㅎ) C3 전환효소, 즉 C4b2a 복합체는 병원체 세포벽에 붙은 상태로 이제 매우 열심히 주변의 C3를 분절(전환)시키는데 1 분자의 C 전환효소가 최대 1000개의 C3분자를 분절하여 활성화시킬 수 있음을 주목해야 한다.
2. 렉틴 경로 (Lectin pathway) : 선천 면역
고전적 경로와 비슷하면서도 약간의 차이가 있는 경로이다. 고전적 경로에서 주로 항체의 주도하에 병원체를 인식하였다면, 렉틴 경로는 항체 대신, 특정한 탄수화물을 인식할 수 있는 능력이 있는 수용성 단백질인 렉틴을 특정 수용체로 사용하여 외부로부터 기인한 항원을 식별한다는 점만 다르다. 항체와 무관한 렉틴 경로는 선천면역체계에 속한다.
2-1 만노스 결합 렉틴(MBL: Mannose-binding lectin) 경로
C1 복합체 대신 MBL, 즉 만노스(Mannose)에 결합하는 렉틴을 통해 활성화된다. 이 경로는 앞서 다룬 고전적 보체 활성화 과정과 매우 비슷하다. 차이가 있다면, C1복합체가 하는 일을 MBL이 한다는 것이고, C1r과 C1s의 역할을 MASP-1과 MASP-2가 수행한다는 점이다. MASP(MBL-associated serine protease)는 이름 그대로 MBL과 연관된 세린 프로테아제란 뜻으로, 활성화되면 C4와 C2를 분절한다. 이들 MASP도 역시 평상시에는 비활성화된 지모겐 형태로 존재한다. C1복합체처럼 MBL도 콜라겐 유사 도메인과 렉틴 결합 도메인(탄수화물 감식 부위)을 포함하고 있어 콜렉틴 계열이다.

우리에게 없는 탄수화물인데?
MBL은 항체도 없는 상황에서 어떻게 병원체, 즉 항원을 인식하고 결합하는 것일까? 우리의 세포는 인지질로 이루어진 2개의 층으로 된 세포막으로 둘러싸여 있다. 그리고 세포밖을 향하거나 또는 세포막을 관통하여 기다랗게 관통하는 당단백질(glycoprotein)이 세포막의 표면에 존재한다. 당단백질들은 글자 그대로 단백질과 올리고당(짧은 다당류)이 공유결합한 것으로, 이들의 말단은 대부분 시알산(sialic acid)이나 갈락토스로 이루어져 있다. 하지만, 효모의 당단백질은 대부분 단당류 만노스(Mannose)로 구성되고, 박테리아의 세포벽이나 일부 바이러스의 세포벽에서도 만노스가 발견된다. 살모넬라, 리스테리아와 같은 미생물, 칸디다 진균, HIV1와 같은 세포들의 표면에서도 만노스당 잔기들이 발견된다. 즉, 말단의 탄수화물 당 성분들이 숙주와 다르다. 콜렉틴과 같은 패턴 인식 수용체 들은 self의 탄수화물 말단 패턴과 다르게 생긴 패턴을 반복적으로 마주치게 되면 이를 외부로부터 들어온 것으로 인식할 수 있는 구조를 가지고 있다. 패턴 인식수용체들이 자아(self)와 비자아(nonself)를 구별하고, 다양한 미생물들과 결합하여 필요한 효과기 기능을 수행할 수 있기 때문에 이들을 선천면역의 1차 방어체계에 속한다고 말하는 것이다. MBL은 간에서 생성되어 혈장에서 낮은 농도로 존재하지만, 감염 시 급성기 반응의 일부로 갑자기 생성이 급증한다.

고전적 경로에서 C1q가 항체나 병원체에 결합하면 C1r이 자동활성화되어 C1s를 활성화시켰듯이 MBL이 병원체에 결합하면 MASP-1이 자동 활성화되어 구조적 변화가 생기고 곧이어 MASP-2를 분절하여 활성화시킨다. MASP-1과 MASP-2 역시 세린 프로테아제로서 비활성 전구체로 존재하다가 활성화된 것이다. 그 이후 고전적 경로와 같은 분절과정을 거쳐 C3 전환효소를 생성하는데, MASP-1과 MASP-2 두 효소 모두 C2를 절단하지만 MASP-2만 C4를 절단한다. 그리고 C3 전환효소 생성을 위한 촉매적 활성은 고전적 경로의 C1보다 MASP-2의 촉매 작용이 1000배나 더 높다는 특징이 있다. [1] 항체 생성이 가능해지기 전까지 선천 면역이 시간을 벌어줄 수 있는 것이다. MASP-3는 MASP-2과 경쟁적인 관계에 있으므로 C3 전환효소 합성을 감소시킬 수 있기 때문에 보체작용의 억제제로 볼 수 있다. 하지만, MASP-3가 다음에 소개할 대체경로에서 보체 인자 B를 분절 활성화 킬 수 있는 보체 인자 D를 독점적으로 활성화시킬 수 있기 때문에 렉틴 경로와 대체 경로가 근본적으로 연결되어 있다는 비교적 최근(2016년)의 보고서도 있다. [2]
| 콜렉틴(Collectin) 이름에 나타나있듯이, 이 단백질은 한쪽 끝(아미노 말단)은 콜라겐 유사 도메인을, 다른 쪽 끝 카르복시 말단에는 칼슘 의존적인 렉틴 도메인을 갖고 있는 올리고머 단백질 유형으로서 동물에서 발견된다. 식물의 렉틴과 구별된다. 이 들은 미생물 표면에 있는 특정 탄수화물 구조나 지질을 인식하고 결합하는 패턴 인식수용체(PRR: Pattern recognition receptors)로서 선천면역체계의 일부이다. 패턴 인식 수용체란, 숙주의 미생물 센서로서 미생물 내부에는 보존되어있지만 숙주(인체)에는 존재하지 않는 특이적 분자들인 미생물 관련 분자 패턴(PAMP : Pathogen-associated molecular patterns), 그리고 숙주가 보내는 스트레스 신호로서 세포가 손상되었거나 또는 사망 중에 방출되는 숙주 세포의 구성 요소와 관련된 손상 관련 분자 패턴 (Damage-associated molecular patterns: DAMP)와 결합하여 식별하여 다양한 면역반응을 개시한다. 항원인지 아닌지를 판단하는 역할을 한다. 참고로, PAMP의 예를 몇가지만 들자면 박테리아 탄수화물 지질다당류(LPS), 만노스(Mannose), 핵산(박테리아나 바이러스의 DNA나 RNA), 플라젤린(flagellin)과 같은 박테리아 펩타이드, 펩티도글리칸(peptidoglycans: 인간을 비롯한 진핵생물에는 없고 미생물과 같은 원핵생물의 세포벽에서 발견됨)등이 있고, 요산이나 세포밖에서 발견되는 ATP 등이 DAMP에 속한다. |
2-2 피콜린(ficolin) 경로
렉틴 경로에 활용되는 또 다른 패턴 인식 수용체로 피콜린(ficolin)이 있다. 전체적인 모양과 기능은 MBL과 유사하지만, MBL이 콜라겐 유사 도메인과 렉틴 결합 도메인을 갖는 반면 ficolin은 콜라겐 유사 도메인과 피프리노겐(fibrinogen) 유사 도메인을 갖는다. 피콜린을 다른 말로 "피브리노겐 유사 도메인을 기능적 도메인으로 사용하는 새로운 형태의 렉틴"이라고 하기도 한다. [3]. 피브리노겐 유사 도메인으로 인해 박테리아 등의 아세틸화된 올리고당들에 대해 특이성을 갖지만, 만노스당 잔기를 갖고 있는 탄수화물에는 결합하지 않는다. 인체는 3종류의 피콜린(L-피콜린(ficolin-2), M-피콜린(ficolin-1), H-피콜린(ficolin-3)을 가지며, L과 H-피콜린은 간에서 합성되어 혈액을 순환하고 M-피콜린은 폐와 혈액 세포에서 분비된다. 피콜린 경로 역시 MBL 경로처럼 MASP-1과 MASP-2가 활성화되어 같은 방식으로 C3전환효소 생성까지 진행된다.
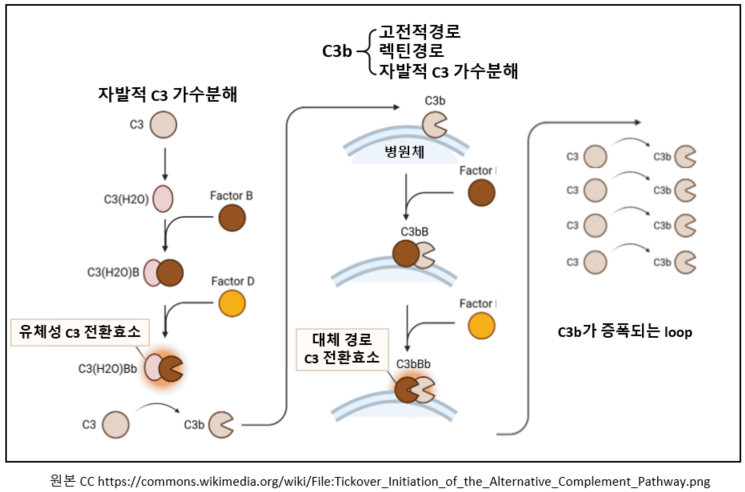
3. 대체 경로(alternative pathway) : 선천 면역
고전적 경로나 렉틴 경로가 cascade식 활성화 단계를 시작하려면 항체와 결합을 하거나 병원체 표면의 탄수화물 등과 같은 외인성 물질과 먼저 결합해서 활성화되어야 한다. 하지만 대체 경로는 이러한 직접적인 결합과정이 없이 C3 전환효소를 생성한다. 대체경로는 2가지로 시작된다. 첫 번째는 이미 우리가 잘 알고 있는 앞선 두 경로를 통해 이미 생성된 C3b를 통해 시작하는 것이고, 두 번째는 불안정한 C3가 스스로 가수분해하여 생성된 C3(H2O)를 통해 시작하는 것이다. 이러한 자발적 가수분해를 “tick over” 과정이라고 하는데 대체 경로에서 특이하게 나타나는 현상이다. 대체 경로에서만 등장하는 보체 구성요소들이 있는데, 보체 B 인자(Complement factor B: CFB), 보체 D 인자(Complement factor D: CFD), 프로퍼딘(properdin) 또는 보체 P 인자(Complement factor P: CFP)가 그것이다. 이들의 역할을 대체 경로 과정과 함께 살펴보자.
먼저 기존에 만들어진 C3b 단편으로 대체 경로가 어떻게 C3 전환효소를 생성하는지 살펴보자. 고전적 경로나 렉틴경로를 통해 생성된 후 미생물 등의 병원체 세포 표면에 공유결합 상태로 붙어있는 C3b 단편에 보체 인자 B가 결합한다. 이 결합은 인자 B의 구조에 변화를 야기하고, 그 변화는 혈청 프로테아제인 또 다른 보체 인자 D가 인자 B를 Ba와 Bb 조각으로 쉽게 분절시킬 수 있게 만든다. 인자 D는 보체계에서 유일하게 지모겐이 아닌 활성화된 상태로 순환하는 프로테아제로서 고전적 경로나 렉틴 경로에서 그 기능에 상응하는 요소를 찾을 수 없는 유일한 부분으로 알려져 있다. 인자 B는 고전적 경로에서의 C2와 구조적, 기능적 유사성을 보이는 등, 서로 밀접한 관련이 있는 단백질로 둘 다 비활성상태인 지모겐으로 존재한다. 분절 후 Ba는 떨어져 나가고, Bb조각과 C3b조각이 세포 표면에 붙은 채 함께 복합체(C3bBb)를 형성하여 C3전환효소가 된다.
"Tick over" 과정
이번에는 자연발생적 과정을 통한 대체 경로를 살펴보자. C3 내부의 티올에스터 결합이 주변의 물과 반응하여 가수분해 되거나 또는 주변에 존재하는 소량의 혈장단백질 분해효소와 반응하여 구조적으로 변형된 C3(H2O) 또는 iC3라는 중간체를 생성한다. 이렇게 전체 C3 분자 중 1% 정도가 아주 느리지만 꾸준히 자발적으로 가수 분해되는 현상을 “tick over” 과정이라고 하는데, 이렇게 자발적으로 생성된 C3(H2O)에 마그네슘(Mg2+)이 존재하는 조건하에서 위의 경우처럼 보체 인자 B가 와서 결합한다.[4] C3(H2O)에 결합한 인자 B 역시 보체 인자 D에 의해 분절되어 Ba와 Bb 조각을 생성할 수 있다. Bb 조각과 C3(H2O) 역시 복합체(C3(H2O)Bb)를 형성하여 C3 전환효소가 되는데 이들은 혈청에만 머물뿐 병원체의 세포표면에는 부착되지 않은 효소들이므로 이 단계를 유체상 전환효소(fluid-phase convertase)라고 한다. 이 전환효소는 혈정에서 비록 수명은 짧지만, 다수의 C3 분자를 C3a와 C3b로 분절시킬수 있다.이렇게 생성된 C3b는 다시 보체 인자 B와 결합하여 위의 첫번째 대체 경로 시작 방법 처럼 C3bBb C3전환효소가 되어 C3(H2O)Bb C3 전환효소를 대체한다. 하지만, 여전히 C3bBb C3 전환효소는 불안정하기 때문에 프로퍼딘(properdin, 또는 보체 P 인자)가 결합하여 안정성을 높여준다. 프로퍼딘은 활성화된 호중구나 대식세포가 면역반응을 위해 발사하는 과립안에 들어있는 성분으로 병원체의 표면에 결합할 수 있는 특성으로 새로이 생성된 C3전환효소들을 세포표면에서 안정화시켜주고 붕괴를 방지해 준다. 프로퍼딘과 결합하여 안정성을 확보한 C3bBb C3 전환효소는 이제 매우 빠르게 C3b 분자를 생산해 낸다. 이들은 다시 보체 인자 B와 결합하여 같은 과정을 반복하는 양성피드백을 형성하여 엄청난 수의 C3b를 짧은 시간 내에 생산할 수 있다.
| 양성피드백, 또는 양성 되먹임(positive feedback) 어떤 원인이 결과를 초래했을 때, 그 결과가 원인에 다시 작용하여 궁극적으로는 결과가 더 많이 일어나게 만들어 결과적으로 증폭되는 과정(loop)을 말한다. 즉, 자극에 대한 반응이 같은 자극을 더욱 증폭시키거나 더 일어나게 만드는 방식이다. 사실 생리적인 측면에서 양성 피드백은 드물다. 오히려 그 반대인 음성피드백이 훨씬 더 흔한데, 이는 자극으로 어떤 결과가 생겼을 경우, 증폭을 방지하고 밸런스를 유지하기 위해 오히려 그 자극을 줄이게 만드는 방식을 말한다. 일반적으로 대부분의 호르몬이 많이 분비되면, 이에 반응하여 해당 호르몬의 생성을 줄이는 것이 그 예이다. 체온이 올라가면 이를 떨어뜨리려는 반응도 음성 피드백의 좋은 예이다. 양성피드백의 예로 주로 드는 것이 분만시 분비되는 옥시토신 호르몬이다. 출산에 이를때까지 옥시토신 분비를 계속 증가시켜 분비하게 한다. |
정리하자면, 대체 경로에는 자발적 가수분해를 통해 생성되어 혈청에 존재하는 C3(H2O)Bb C3 전환효소(유체성)과 이 효소가 분절하여 생겼거나 다른 경로를 통해 이미 생성된 C3b 조각과 Bb 조각이 결합하여 생성된 C3bBb C3전환효소의 2가지 형태가 모두 존재한다. 그리고 이 경로의 특징은 양성피드백을 통해 C3b 생산을 증폭시킬 수 있다는 점이다. 그리고 다음에서 C5 전환효소 생성에 C3b가 직접 관련됨을 본다.
C5 전환효소(C5 Convertase)
보체의 주요 기능에서 핵심적인 구성요소가 C3분자와 C5분자인데 이들을 분절시켜 활성화시킬 프로테아제들을 생산하는 것이 보체 활성화 과정에서 2개의 주요 목적이다. 그리고 이들 프로테아제들은 각각 바로 전단계에서 활성화된 효소에 의해 활성화되어야 한다. 자칫 벌어질 수 있는 숙주의 피해를 방지하고자 하는 철저한 통제와 조절의 과정으로 짐작된다. 앞에서 C3를 분절하는 C3 전환효소를 만드는 3가지 경로, 즉 3가지 방법들을 자세히 살펴보았다. 이제 모든 경로들은 각자가 만든 C3 전환효소에 C3b단편을 다시 결합시켜 C5 전환효소를 만들고 C5를 C5a와 C5b로 분절한다. 단편들이 분절되는 경로를 살펴보았으니 이제 본격적으로 보체들이 숙주 방어를 위해 어떤 맹활약을 펼치는지 알아보자.
[참고 자료]
[1] MASP1 and MASP2
https://doi.org/10.1007/978-1-4614-6438-9_101714-1
[2] MASP-3 is the exclusive pro-factor D activator in resting blood: the lectin and the alternative complement pathways are fundamentally linked
https://doi.org/10.1038/srep31877
[3] The role of ficolins in the lectin pathway of innate immunity
https://doi.org/10.1016/j.biocel.2011.02.003
[4] Roitt’s Essential Immunology, Thirteenth Edition. Peter J. Delves, Seamus J. Martin, Dennis R. Burton, and Ivan M. Roitt. Published 2017 by John Wiley & Sons, Ltd
[기본 자료]
Kuby Immunology. 8th New York: Macmillan Learning, 2019. Text. MLA Style. Punt, Jenni, Stranford, Sharon A, Jones, Patricia P, Owen, Judith A
Janeway's immunobiology. Kenneth Murphy, Janeway Jr., Paul Travers, Walport Sir. 9th Edition, New York, Garland Science/Taylor & Francis Group, LLC, [2016]
Fundamental Immunology 5th edition (August 2003): William E. Paul(Editor). Philadelphia : Lippincott Williams & Wilkins, c2003.
'면역계 > 보체계' 카테고리의 다른 글
| 보체 4: 보체의 규제와 억제장치 (1) | 2024.10.25 |
|---|---|
| 보체 3: 보체의 기능 - 옵소닌화, 염증 유도, 막공격복합체 생성 (1) | 2024.10.25 |
| 보체 1: 보체(complement system) (1) | 2024.10.25 |